
| 元素 | 相关信息 |
| X | X的基态原子价层电子中有两个未成对电子 |
| Y | Y的基态原子最外层电子排布式为:nsnnpn+2 |
| Z | Z存在质量数为23,中子数为12的核素 |
| W | W有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色 |
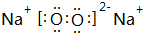 ,请写出Z2Y2与XY2反应的化学方程式2Na2O2+2CO2=2Na2CO3+O2.
,请写出Z2Y2与XY2反应的化学方程式2Na2O2+2CO2=2Na2CO3+O2.分析 Y的基态原子最外层电子排布式为:nsnnpn+2,s能级最多容纳2个电子,则n=2,故Y为O元素;X的基态原子价层电子中有两个未成对电子,原子序数小于氧,则核外电子排布式为1s22s22p2,故X为C元素;Z存在质量数为23,中子数为12的核素,其质子数为23-12=11,故Z为Na;W有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色,则W为Fe.
解答 解:Y的基态原子最外层电子排布式为:nsnnpn+2,s能级最多容纳2个电子,则n=2,故Y为O元素;X的基态原子价层电子中有两个未成对电子,原子序数小于氧,则核外电子排布式为1s22s22p2,故X为C元素;Z存在质量数为23,中子数为12的核素,其质子数为23-12=11,故Z为Na;W有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色,则W为Fe.
(1)同周期自左而右电负性增大、非金属性增强,故X(碳)电负性比Y(氧)的小,氧的非金属更强,则氢化物中H2O较稳定,
故答案为:小;H2O;
(2)W为Fe元素,在周期表中的位置是:第四周期第Ⅷ族,其基态原子价电子的电子排布式为3d64s2,
故答案为:第四周期第Ⅷ族;3d64s2;
(3)Na2O2的电子式为 ,Na2O2与CO2反应的化学方程式:2Na2O2+2CO2=2Na2CO3+O2,
,Na2O2与CO2反应的化学方程式:2Na2O2+2CO2=2Na2CO3+O2,
故答案为: ;2Na2O2+2CO2=2Na2CO3+O2;
;2Na2O2+2CO2=2Na2CO3+O2;
(4)在CO2分子中C原子的杂化方式为sp杂化,其分子的空间构型为直线形,氢、C、O三种元素可共同形成多种分子和一种常见无机阴离子,其中一种分子与该无机阴离子反应的离子方程式:HCO3-+CH3COOH=CH3COO-+CO2↑+H2O,
故答案为:sp;直线形;HCO3-+CH3COOH=CH3COO-+CO2↑+H2O.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、元素周期律、杂化方式与空间构型、电子式、元素化合物性质等,推断元素是解题关键,注意对基础知识的理解掌握.


 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 1 mol S(g)与1 mol O2(g) 的总能量比1 mol SO2(g)的总能量低QkJ | |
| B. | 1mol S(g) 与1 mol O2(g) 反应生成1 mol SO2(g)放出Q kJ的热量 | |
| C. | S(s)+O2(g)=SO2(g)△H<-Q kJ•mol-1 | |
| D. | 1个S(g)与1个O2(g) 完全反应可以放出Q kJ的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 月球上的二氧化硅所含元素都是第三周期元素 | |
| B. | 3He可发生核聚变反应,这是一种化学变化 | |
| C. | 月球上的3He是一种新元素 | |
| D. | 月球和地球上的钛、铁、铬、镍等原子应该具有相同的核外电子排布 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当体系的体积不再发生变化,该反应已建立平衡 | |
| B. | 达到平衡后向体系中充入少量He,平衡不移动 | |
| C. | 增大水蒸气的用量可以提高碳粉的转化率 | |
| D. | 若断裂1 molH-H键的同时断裂2molH-O键,则反应达到平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 开启啤酒瓶后,瓶中马上泛起大量泡沫 | |
| B. | 将收集NO2气体的烧瓶密闭后,放在装有热水的烧杯中,发生颜色变化 | |
| C. | 合成氨时采用铁触媒作反应催化剂 | |
| D. | 工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuSO4+H2S═CuS↓+H2SO4 | B. | 2FeCl3+Cu═2FeCl2+CuCl2 | ||
| C. | Cu2(OH)2CO3$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+CO2↑+H2O | D. | 4Fe(OH)2+O2+2H2O═4Fe(OH)3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com