
分析 (1)水中有还原性物质能与反应KMnO4;
(2)加热温度低于100℃时,一般采用水浴加热;
(3)KMnO4溶液具有强氧化性用酸式滴定管量取;
(4)选做基准试剂的物质必须满足纯度高、稳定性好,如硫酸亚铁、亚硫酸钠容易被氧化变质的试剂不能作为基准试剂,浓盐酸具有挥发性,也不能做基准试剂;
(5)①滴定终点时最后滴下1滴KMnO4溶液后变色而且半分钟不褪色;
②先计算草酸的物质的量浓度,再根据草酸和高锰酸钾之间的关系式计算高锰酸钾的物质的量浓度;
(6)长时间放置后,高锰酸钾溶液浓度变小.
解答 解:(1)由于KMnO4的强氧化性,它的溶液很容易被空气中或水中某些少量还原性物质还原,生成难溶性物质MnO(OH)2,所以要除去水中的还原性物质,则将溶液加热并保持微沸1h的目的是将水中还原性物质完全氧化;
故答案为:将水中还原性物质完全氧化;
(2)加热温度低于100℃时,一般采用水浴加热,则要保证在70℃~80℃条件下进行滴定操作,应该水浴加热,用温度计控制水温;
故答案为:水浴加热,用温度计控制水温;
(3)KMnO4溶液具有强氧化性能氧化碱式滴定管中的橡胶管,所以不能用碱式滴定管量取,应该用酸式滴定管量取;
故答案为:酸式滴定管;
(4)A.H2C2O4•2H2O常温下是稳定的结晶水水化物,溶于水后纯度高、稳定性好,可以用作基准试剂,故A正确;
B.FeSO4在空气中不稳定,亚铁离子容易被氧化成铁离子,不宜用作基准试剂,故B错误;
C.浓盐酸不稳定,易挥发,不宜用作基准试剂,故C错误;
D.Na2SO3具有还原性,在空气中容易被氧化成硫酸钠,不宜用作基准试剂,故D错误;
故答案为:A;
(5)①滴定时滴入最后一滴,高锰酸钾不完全反应,溶液变成浅红色并保持半分钟不褪色,说明滴定到达终点;
故答案为:滴入最后1滴KMmO4溶液,溶液颜色从无色变成浅红色,且半分钟内不褪色;
②草酸的物质的量浓度为:$\frac{\frac{Wg}{126g/mol}}{0.5L}$=$\frac{W}{63}$mol/L,根据反应方程式6H++2MnO4-+5H2C2O4•2H2O═2Mn2++10CO2↑+18H2O中草酸和高锰酸钾之间的关系式得,酸性高锰酸钾的物质的量浓度=$\frac{\frac{W}{63}mol/L×0.025L×\frac{2}{5}}{V×10{\;}^{-3}L}$=$\frac{W}{6.3V}$mol/L,
故答案为:$\frac{W}{6.3V}$;
(6)在放置过程中,由于空气中还原性物质的作用,使KMnO4溶液的浓度变小了,再去滴定水样中的Fe2+时,需要消耗KMnO4溶液(标准溶液)的体积会增大,导致计算出来的c(Fe2+)值会增大,测定的结果偏高,
故答案为:偏高.
点评 本题考查了滴定实验的应用,题目难度中等,明确滴定原理是解答本题的关键,注意基准试剂的选取方法,侧重于考查学生的实验探究能力和计算能力.


 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:填空题
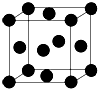 用晶体的X射线衍射法对Cu的测定得到以下结果:Cu的晶胞为面心立方最密堆积(如图),已知该晶体的密度为9.00g•cm-3,晶胞中该原子的配位数为12;Cu的原子半径为$\frac{\sqrt{2}}{4}×\root{3}{\frac{4×64}{9.00×6.06×1{0}^{23}}}$cm=1.27×10-8cm(阿伏加德罗常数为NA,列出计算表达式,不用化简).
用晶体的X射线衍射法对Cu的测定得到以下结果:Cu的晶胞为面心立方最密堆积(如图),已知该晶体的密度为9.00g•cm-3,晶胞中该原子的配位数为12;Cu的原子半径为$\frac{\sqrt{2}}{4}×\root{3}{\frac{4×64}{9.00×6.06×1{0}^{23}}}$cm=1.27×10-8cm(阿伏加德罗常数为NA,列出计算表达式,不用化简).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16g臭氧所含的原子数为NA | |
| B. | 22.4LCO气体的物质的量为1mol | |
| C. | CO的摩尔质量为28g | |
| D. | 标准状况下1mol水的体积约为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
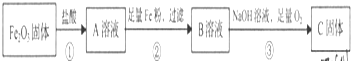
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2的水溶液能导电,说明SO2是电解质 | |
| B. | Al(OH)3有弱碱性,可用于中和胃酸 | |
| C. | 铜的金属性比铝弱,可以用铜罐贮运浓硝酸 | |
| D. | 明矾和漂白粉常用于自来水的净化和消毒,两者原理相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{a}{A+m}$(Z+m)mol 质子 | B. | $\frac{a}{A}$(A-Z+m)mol 中子 | C. | $\frac{a}{A+m}$(Z-m)mol 质子 | D. | $\frac{a}{A}$m mol 氢元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol SiO2中共价键总数为2NA | |
| B. | 常温下,64g NO2中含质子总数为23NA | |
| C. | 标准状况下,22.4L丙烯和环丙烯的混合气体中氢原子个数为0.2NA | |
| D. | 0.2mol Fe在0.2mol Cl2中燃烧失去的电子数为0.6NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com