
【题目】减少氮的氧化物和碳的氧化物在大气中的排放是环境保护的重要内容之一。合理应用和处理碳、氮及其化合物,在生产生活中有重要意义。
(1)对温室气体 CO2 的研究一直是科技界关注的重点。在催化剂存在下用 H2 还原 CO2 是解决溫室效应的重要手段之一。
已知:①H2 和 CH4 的燃烧热分别为 285.5 kJ/mol 和 890.0 kJ/mol。
②H2O(1)===H2O(g) ΔH=+44 kJ/mol
试写出H2还原CO2生成CH4和H2O(g)的热化学方程式_____。
(2)CO2在CuZnO催化下,可同时发生如下的反应I、II,其可作为解决温室效应及能源短缺的重要手段。
I.CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)ΔH1=-57.8kJ/mol
CH3OH(g)+H2O(g)ΔH1=-57.8kJ/mol
II.CO2(g)+H2(g)![]() CO(g)+H2O(g)ΔH2=+41.2kJ/mol
CO(g)+H2O(g)ΔH2=+41.2kJ/mol
对于气体参加的反应,表示平衡常数Kp时,用气体组分(B)的平衡分压p(B)代替该气体的平衡浓度c(B),则反应II的Kp=_____[已知:气体各组分的分压p(B),等于总压乘以其体积分数]。
在CuZnO存在的条件下,保持温度T不变,在一刚性密闭容器中,充入一定量的CO2及H2,起始及达平衡时,容器内各气体物质的量如下表:
CO2 | H2 | CH3OH | CO | H2O(g) | 总压/kPa | |
起始/mol | 5.0 | 7.0 | 0 | 0 | 0 | p0 |
平衡/mol | n1 | n2 | p |
若反应I、II均达平衡时,p0=1.2p,则表中n1/span>=_____;若此时n2=3.则反应I的平衡常数Kp=_____(无需带单位,用含总压p的式子表示)。
(3)汽车尾气是雾霾形成的原因之一,研究氮氧化物的处理方法可有效减少雾霾的形成。可采用氧化还原法脱硝:4NO(g)+4NH3(g)+O2(g)![]() 4N2(g)+6H2O(g)ΔH<0
4N2(g)+6H2O(g)ΔH<0
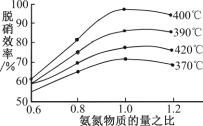
(4)根据图示判断提高脱硝效率的最佳条件是_____;氨氮比一定时,在400℃时,脱硝效率最大,其可能的原因是_____。用活性炭还原法也可以处理氮氧化物,某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应:C(s)+2NO(g)![]() N2(g)+CO2(g)ΔH>0在T℃时,反应进行到不同时间测得各物质的量浓度如下:
N2(g)+CO2(g)ΔH>0在T℃时,反应进行到不同时间测得各物质的量浓度如下:
时间/min | 0 | 10 | 20 | 30 | 40 | 50 |
c(NO)/molL1 | 1.0 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
c(N2)/molL1 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
c(CO2)/molL1 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
30min后,只改变某一条件,根据上表的数据判断改变的条件可能是______填字母)。
A.通入一定量的 CO2 B.加入合适的催化剂 C.适当缩小容器的体积
D.通入一定量的 NO E.加入一定量的活性炭 F.适当升高温度
【答案】![]()
![]() 1.0mol
1.0mol ![]() 400℃下,氨氮比1.0 温度过低,反应速率太慢,温度过高,平衡常数太低 CD
400℃下,氨氮比1.0 温度过低,反应速率太慢,温度过高,平衡常数太低 CD
【解析】
本题是一道化学反应原理的综合题,难度一般,主要考察学生对反应原理的综合掌握能力,按照要求来解答即可。
(1)将![]() 设为式①,
设为式①,![]() 设为式②,水的蒸发设为式③,则用
设为式②,水的蒸发设为式③,则用![]() 即可得到
即可得到![]() ,再根据盖斯定律
,再根据盖斯定律![]() 算出反应热即可;在条件一定的情况下,气体的分压和物质的量成正比,而物质的量与浓度也成正比,因此可用压强来代替浓度,因此
算出反应热即可;在条件一定的情况下,气体的分压和物质的量成正比,而物质的量与浓度也成正比,因此可用压强来代替浓度,因此![]() ;
;
(2)若只发生反应II,反应前后气体分子数不变,压强是不变的,因此只有反应I能改变压强;根据化学计量数之比,每生成1mol甲醇,气体分子总数就要减少2mol,则![]() ,解得
,解得![]() ;此时体系中气体总物质的量为10mol,因此
;此时体系中气体总物质的量为10mol,因此![]() ,
,![]() ,又因为体系中一共消耗了3mol
,又因为体系中一共消耗了3mol ![]() ,所以平衡时剩余的
,所以平衡时剩余的![]() 的分压为
的分压为![]() ,同理
,同理![]() ,代入反应I的化学平衡表达式
,代入反应I的化学平衡表达式![]() 解得
解得![]() ;
;
(3)根据图示可以看出当氨氮比为1.0,且温度为400℃时脱硝效率最高,接近100%,故此时为最佳条件;正反应是放热的,因此若温度过高会导致平衡常数减小,反应不能完全进行,但若温度太低会导致反应速率过慢,因此400℃是一个最佳的反应条件;根据表中数据我们发现反应进行到20min时已经达到了平衡状态,一直持续到30min,代入平衡常数的表达式![]() ,在30min时改变了某一条件,在40min时又达到了平衡状态,此时的
,在30min时改变了某一条件,在40min时又达到了平衡状态,此时的![]() ,平衡常数没变说明温度没有改变,因此F项错误;再来分析其它选项,若通入一定量的
,平衡常数没变说明温度没有改变,因此F项错误;再来分析其它选项,若通入一定量的![]() 会导致平衡逆向移动,虽然
会导致平衡逆向移动,虽然![]() 和
和![]() 的浓度都在上升,但是
的浓度都在上升,但是![]() 的浓度是在下降的,因此A是错误的;活性炭是固体,加入一定量的活性炭不会影响平衡,E项错误;而催化剂不影响平衡,B项错误;因此答案为CD,适当缩小体积会让所有气体的浓度都增大,此时虽然平衡会移动导致某些气体减少,但是整体上来讲浓度还是增大的。
的浓度是在下降的,因此A是错误的;活性炭是固体,加入一定量的活性炭不会影响平衡,E项错误;而催化剂不影响平衡,B项错误;因此答案为CD,适当缩小体积会让所有气体的浓度都增大,此时虽然平衡会移动导致某些气体减少,但是整体上来讲浓度还是增大的。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下表是前20号元素中的部分元素的一些数据:
A | B | C | D | E | F | G | H | I | J | |
原子半径(10-10m) | 1.02 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 1.17 |
最高价态 | +6 | +1 | — | +3 | +4 | +5 | +7 | +1 | +5 | +4 |
最低价态 | -2 | — | -2 | — | -4 | -3 | -1 | — | -3 | -4 |
试回答下列问题:
(1)以上10种元素电负性最大的是_____(填元素符号)。比元素B原子序数大7的元素在元素周期表中的位置:第_____周期,第_____族,其基态原子的核外电子排布式是________。
(2)H、I、J三种元素对应单质的熔点依次升高的顺序是(用单质的具体化学式排序)__________。
(3)元素E与C及氢元素可形成一种相对分子质量为60的一元羧酸分子。其分子中共形成________个σ键,________个π键。
(4)I与氢元素形成的10电子分子X的空间构型为________;将X溶于水后的溶液滴入到CuSO4溶液中至过量,得到的络离子的化学式为________,其中X与Cu2+之间以_____________键结合。
(5)下图是I元素形成的含氧酸的结构,请简要说明该物质易溶于水的原因:
a._________________________________。
b._________________________________。
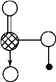
(6) 如图是J和E组成的晶体结构,则每个与J周围最近J原子数目为_________,若晶胞边长为a cm,则晶体的密度为_______________(用含a、NA的代数式表示)(g/mL)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图1是元素周期表的一部分,表中所列的字母分别代表一种化学元素。
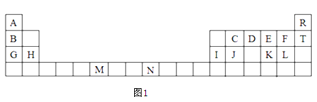
试回答下列问题:
(1)F-的结构示意图:__。
(2)D的气态氢化物的VSEPR模型为___,其中心原子的杂化类型为___,分子的空间构型为___。
(3)G、H和I的第一电离能数值由大到小的顺序为:___(用元素符号作答)。
(4)元素M的化合物(MO2Cl2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应。请回答下列问题:
①与M同周期的所有元素的基态原子中最外层电子数与M原子相同的元素还有____(填元素符号)。
②MO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断MO2Cl2是___(填“极性”或“非极性”)分子。
③在C2H4、CH3Cl、CH2O、CS2、CCl4五种有机化合物中,碳原子采取sp2杂化的分子有___(填分子式)。
(5)已知元素N可形成一种红紫色配合物,其组成为NCl3·5NH3·H2O。该配合物中的中心离子N离子在基态时核外简化电子排布式为___,又已知中心离子N离子的配位数是6,1mol该物质与足量的硝酸银反应可生成3molAgCl,则该物质的配体是___。
(6)过去常以JE2为催化剂的载体。JE2的晶胞可作如下推导:先将NaCl晶胞中的所有Na+去掉,并将Cl-全部换成J原子,再在每两个不共面的“小立方体”中心处各放置一个J原子便构成了晶体J的一个晶胞,则一个J的晶胞中有___个J原子,再在每两个相邻的J原子(距离最近的两个J原子)中心连线的中点处增添一个E原子,便构成了JE2晶胞,故JE2晶胞中有___个E原子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物甲与乙在一定条件下可反应生成丙:
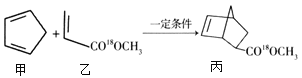
下列说法正确的是
A. 甲与乙生成丙的反应属于取代反应
B. 甲分子中所有原子共平面
C. 乙的一氯代物有2种
D. 丙在酸性条件下水解生成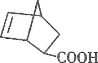 和CH318OH
和CH318OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2,某同学在实验室中对NH3与NOx反应进行了探究。回答下列问题:
(1)氨气的制备

①氨气的发生装置可以选择上图中的________,反应的化学方程式为______________。
②预收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:发生装置→______(按气流方向,用小写字母表示)。
(2)氨气与二氧化氮的反应将上述收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好)。在一定温度下按图示装置进行实验。

操作步骤 | 实验现象 | 解释原因 |
打开K1,推动注射器活塞,使X中的气体缓慢通入Y管中 | ①Y管中_____________ | ②反应的化学方程式 ____________ |
将注射器活塞退回原处并固定,待装置恢复到室温 | Y管中有少量水珠 | 生成的气态水凝集 |
打开K2 | ③_______________ | ④______________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硫分子(SO2)分子中共有__个σ键,其中心原子(硫原子)的孤电子对数为__;价层电子对数为__,该分子的VSEPR模型为__;则该分子呈__形,二氧化硫分子的中心原子的杂化类型为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是古丝绸之路中的重要贸易商品,下列有关说法错误的是
|
|
|
|
瓷器 | 丝绸 | 茶叶 | 酒 |
A.陶瓷由黏土经高温烧结而成,其主要成分是硅酸盐
B.丝绸的化学成分主要是纤维素,纤维素属于天然有机高分子化合物
C.茶叶中含多种酚类物质,经常饮用可抗氧化、防衰老
D.我国劳动人民很早就掌握了酿酒技术,但自酿酒中可能会含有甲醇等有害物质,不建议直接饮用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属铁用途广泛,高炉炼铁的总反应为:Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g),请回答下列问题:
2Fe(s)+3CO2(g),请回答下列问题:
(1)一定温度下,在体积固定的密闭容器中发生上述反应,可以判断该反应已经达到平衡的是___________
A.密闭容器中总压强不变
B.密闭容器中混合气体的平均摩尔质量不变
C.密闭容器中混合气体的密度不变
D.c(CO)=c(CO2)
E.Fe2O3的质量不再变化
(2)一定温度下,上述反应的化学平衡常数为3.0,该温度下将4molCO、2molFe2O3、6molCO2、5molFe加入容积为2L的密闭容器中,此时反应将向________________反应方向进行(填“正”或“逆”或“处于平衡状态”);反应达平衡后,若升高温度,CO与CO2的体积比增大,则正反应为______________反应(填“吸热”或“放热”)。
(3)已知:3Fe2O3(s)+CO(g)![]() 2Fe3O4(s)+CO2(g) △H=–47kJ/mol
2Fe3O4(s)+CO2(g) △H=–47kJ/mol
Fe3O4(s)+CO(g)![]() 3FeO(s)+CO2(g) △H=+19kJ/mol
3FeO(s)+CO2(g) △H=+19kJ/mol
FeO(s)+CO(g)![]() Fe(s)+CO2(g) △H=–11kJ/mol
Fe(s)+CO2(g) △H=–11kJ/mol
则Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g)的 △H=________________。
2Fe(s)+3CO2(g)的 △H=________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据图中相关信息,判断下列说法正确的是( )
A.在NaCl晶体中,距离Na+最近的Cl-形成正四面体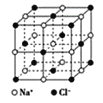
B.该气态团簇分子的分子式为E4F4或F4E4
C.CO2晶胞中每个分子周围有8个紧邻的CO2分子
D.在碘晶体中,碘分子的排列有4种不同的方向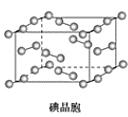
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com