
| A. | 用容量瓶配制溶液时,先用蒸馏水洗涤,再用待装溶液润洗 | |
| B. | 用湿润的红色石蕊试纸检验酸性气体 | |
| C. | 用烧杯加热分解Al(OH)3固体 | |
| D. | 用分液漏斗分离乙酸乙酯和饱和碳酸钠溶液 |
分析 A.容量瓶不能润洗,否则配制的溶液浓度偏高;
B.湿润的红色石蕊试纸遇酸性气体不变色;
C.不能在烧杯中加热固体,可以在试管中完成;
D.乙酸乙酯在饱和碳酸钠溶液中的溶解度较小,可以通过分液操作分离.
解答 解:A.用容量瓶配制溶液时,需要用蒸馏水洗涤,但是不能用待装溶液润洗,否则配制的溶液浓度会偏高,故A错误;
B.酸性气体不能使红色石蕊试纸变色,用湿润的红色石蕊试纸检验的碱性气体,故B错误;
C.给烧杯加热时需要垫上石棉网,且通常给烧杯中液态物质加热,加热分解Al(OH)3固体应该在试管中进行,故C错误;
D.乙酸乙酯与饱和碳酸钠溶液分层,可用分液漏斗分离乙酸乙酯和饱和碳酸钠溶液,故D正确;
故选D.
点评 本题考查了化学实验方案的评价,题目难度中等,涉及溶液配制、气体性质及检验、分液操作等知识,明确常见化学实验基本操作方法为解答关键,试题有利于培养学生的化学实验能力.


 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案科目:高中化学 来源: 题型:选择题
| A. | 还原剂是HCl,氧化剂是MnO2 | |
| B. | 每消耗1 mol HCl,转移电子的物质的量为2 mol | |
| C. | 每生成1 mol Cl2,转移电子的物质的量为2 mol | |
| D. | 生成的Cl2中,除含有一些水蒸气外,还含有HCl杂质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
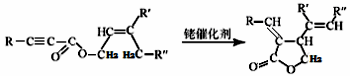 (R、R‘、R“表示氢、烷基或芳基)
(R、R‘、R“表示氢、烷基或芳基)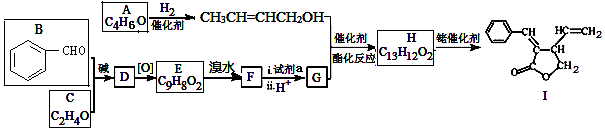
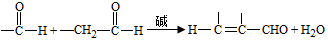
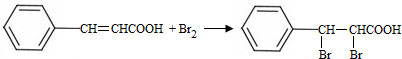 ;试剂a 是NaOH、醇溶液.
;试剂a 是NaOH、醇溶液.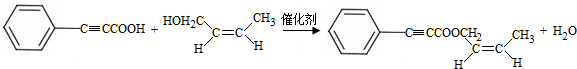 .
.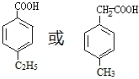 (写出一种即可).
(写出一种即可).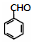 和CH3CHO为原料合成
和CH3CHO为原料合成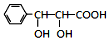 的合成路线流程图:
的合成路线流程图: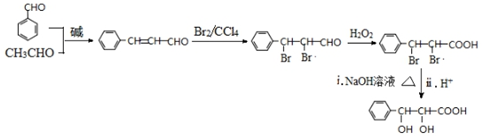 .(其它试剂任选,合成路线常用的表示方式为:CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2$\stackrel{Br_{2}}{→}$
.(其它试剂任选,合成路线常用的表示方式为:CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2$\stackrel{Br_{2}}{→}$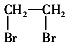 )
)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中肯定不存在的离子只有Cu2+ | B. | Fe3+和Cu2+均完全被铁粉还原 | ||
| C. | 滤液中滴加KSCN溶液显红色 | D. | 滤渣中肯定不含有铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaCl2溶液与Na2CO3溶液加足量稀醋酸 | |
| B. | Ba(OH)2溶液与KNO3溶液加足量H2SO4 | |
| C. | AgNO3溶液与Na2CO3溶液加足量稀硝酸 | |
| D. | Ca(OH)2溶液与FeCl3溶液加足量稀硝酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com