
| A. | 过量HI溶液加入到Fe(NO3)3溶液中:2Fe3++2I-═2Fe2++I2 | |
| B. | 含等物质的量的MgCl2、Ba(OH)2、HNO3三种溶液混合:Mg2++2OH-═Mg(OH)2↓ | |
| C. | CaCO3溶于醋酸:CaCO3+2CH3COOH═Ca2++2CH3COO-+CO2↑+2H2O | |
| D. | 向海带灰浸出液中加入硫酸、双氧水:2I-+H2O2═2OH-+I2 |
分析 A.碘化氢过量,铁离子和硝酸根离子都完全反应,漏掉了硝酸根离子与碘离子的反应;
B.漏掉了氢离子与氢氧根离子生成水的反应;
C.硅酸钙为难溶物、醋酸为弱酸,二者都需要保留化学式;
D.酸性溶液中不会生成氢氧根离子.
解答 解:A.硝酸铁溶液中滴加足量HI溶液,铁离子和硝酸根离子都参与反应,正确的离子方程式为:Fe3++3NO3-+12H++10I-=Fe2++5I2+3NO↑+6H2O,故A错误;
B.含等物质的量的MgCl2、Ba(OH)2、HNO3三种溶液混合,反应生成氯化钡、硝酸钡和水,正确的离子方程式为:2H++Mg2++4OH-═Mg(OH)2↓+2H2O,故B错误;
C.CaCO3溶于醋酸生成醋酸钙、二氧化碳气体和水,反应的离子方程式为:CaCO3+2CH3COOH═Ca2++2CH3COO-+CO2↑+2H2O,故C正确;
D.向海带灰浸出液中加入硫酸、双氧水,发生氧化还原反应,正确的离子方程式:2I-+2H++H2O2═I2+2H2O,故D错误;
故选C.
点评 本题考查了离子方程式的书写,题目难度中等,明确反应实质是解题关键,注意离子方程式书写应遵循客观事实、遵循原子个数、电荷数守恒规律等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 、
、 ;
; ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
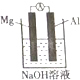 (重)某同学做元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象(见下表,表中的“实验步骤”与“实验现象”前后不一定是对应关系).
(重)某同学做元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象(见下表,表中的“实验步骤”与“实验现象”前后不一定是对应关系). | 实验步骤 | 实验现象 |
| ①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾,再向溶液中滴加酚酞溶液 | A.浮在水面上,熔成小球,四处游动,发生“嘶嘶”声,随之消失,溶液变成红色 |
| ②向新制的Na2S溶液中滴加新制的氯水 | B.有气体产生,溶液变为浅红色 |
| ③将一小块金属钠放入滴有酚酞溶液的冷水中 | C.剧烈反应,迅速产生大量无色气体 |
| ④将镁条投入稀盐酸中 | D.反应开始不十分剧烈,产生无色气体 |
| ⑤将铝条投入稀盐酸中 | E.生成白色胶装沉淀,继而沉淀消失 |
| ⑥向AlCl3溶液中滴加NaOH溶液至过量 | F.生成淡黄色沉淀 |
| 实验内容 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| 实验现象(填1-F) | B |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 肉桂酸甲酯(属于脂类,代号M)是常用于调制具有草莓、葡萄、樱桃、香子兰等香味的使用香精.测得其相对分子质量为162,分子中C、H、O原子个数比为5:5:1,且分子中只含有1个苯环,苯环上只有一个取代基.现测出M的核磁共振氢谱谱图有6个峰,其面积之比为1:2:2:1:1:3.下列说法不正确的是( )
肉桂酸甲酯(属于脂类,代号M)是常用于调制具有草莓、葡萄、樱桃、香子兰等香味的使用香精.测得其相对分子质量为162,分子中C、H、O原子个数比为5:5:1,且分子中只含有1个苯环,苯环上只有一个取代基.现测出M的核磁共振氢谱谱图有6个峰,其面积之比为1:2:2:1:1:3.下列说法不正确的是( )| A. | M的分子式为C10H10O2 | |
| B. | 1mol的M最多能被4molH2还原 | |
| C. | 如图可表示M的其中一种同分异构体的比例模型 | |
| D. | 与M含有相同官能团,且苯环上氢的化学环境只有两种的同分异构体有6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
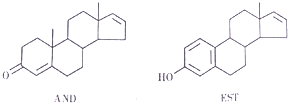
| A. | 这两种分子均能与NaOH溶液反应 | |
| B. | AND和KST分别与足量氢气加成后的两种产物互为同系 | |
| C. | AMD和EST均瓸于芳香族化合物 | |
| D. | EST的M分丼构体中,有的结构中含有葱环(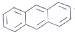 ) ) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
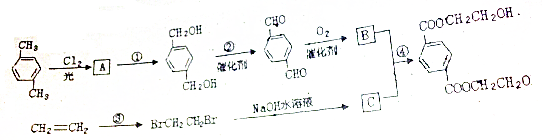
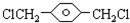 ,
,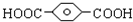 ,HOCH2CH2OH.
,HOCH2CH2OH.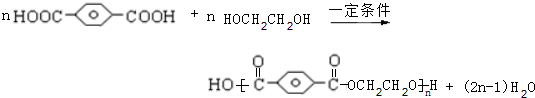 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向KClO3溶液中滴加AgNO3溶液得到白色AgCl沉淀 | |
| B. | 反应过程中I2置换出Cl2,由此可推断非金属性I>Cl | |
| C. | KClO3和KIO3均属于离子化合物,都只含有离子键 | |
| D. | 制备KIO3的反应中氯元素被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
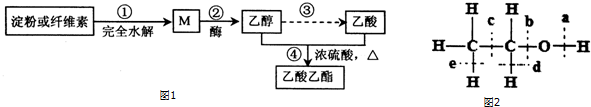
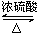 CH3 CH2CO18OCH2CH3+H2O.
CH3 CH2CO18OCH2CH3+H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com