

(1)Ti的原子序数为22,Ti位于元素周期表中第_________周期,第_________族。
(2)步骤①加Fe的目的是___________________________;
步骤②冷却的目的是______________________________。
(3)上述制备TiO2的过程中,可以利用的副产物是__________;考虑成本和废物综合利用因素,废液中应加入__________处理。
(4)由金红石(TiO2)制取单质Ti,涉及到的步骤为
TiO2→TiCl4![]() Ti
Ti
已知:①C(s)+O2(g)![]() CO2(g);ΔH=-393.5 KJ·mol-1
CO2(g);ΔH=-393.5 KJ·mol-1
②2CO(g)+O2(g)![]() 2CO2(g);ΔH=-566 KJ·mol-1
2CO2(g);ΔH=-566 KJ·mol-1
③TiO2(s)+2Cl2(g)![]() TiCl4(s)+O2(g);ΔH=+141 KJ·mol-1
TiCl4(s)+O2(g);ΔH=+141 KJ·mol-1
则TiO2(g)+2Cl2(g)+2C(s)![]() TiCl4(s)+2CO(g)的ΔH=________________。
TiCl4(s)+2CO(g)的ΔH=________________。
反应TiCl4+2Mg![]() 2MgCl2+Ti在Ar气氛中进行的理由是________________。
2MgCl2+Ti在Ar气氛中进行的理由是________________。
解析:(1)前3周期只有18种元素,Ti是第4周期的第4个元素,即位于IVB族。
(2)Fe可将Fe3+还原为Fe2+
2Fe3++Fe![]() 3Fe2+
3Fe2+
②后过滤,得到了FeSO4·7H2O晶体,可见冷却的目的就是为了析出FeSO4·7H2O晶体。
(3)副产物是FeSO4·7H2O晶体。
废液显酸性,应加廉价碱、碱性氧化物或弱酸盐中和其酸性。
(4)③+①×2-②得要求“ΔH”的反应,故
ΔH=141kJ·mol-1+(-393.5 kJ·mol-1)×2 -(-556 kJ·mol-1)=-90kJ·mol-1
Ar隔绝空气,可以防止Ti、Mg被氧化。
答案:(1)4 IVB (2)将Fe3+还原为Fe2+ 析出(或分离、或得到)FeSO4·7H2O
(3)FeSO4·7H2O 石灰(或碳酸钙、废碱)
(4)-90 kJ·mol-1 防止高温下Mg(Ti)与空气中的O2(或CO2、N2)作用


 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源:山东省兖州市2011届高三开学考试化学试题 题型:022
钛被称为继铁、铝之后的第三金属.如下图所示,将钛厂、氯碱厂和甲醇厂组成产业链可以大大提高资源利用率,减少环境污染.
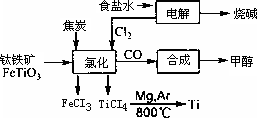
请填写下列空白:
(1)电解食盐水时,总反应的离子方程式是________.
(2)写出钛铁矿经氯化法得到四氯化钛的化学方程式:________.
(3)已知:①Mg(s)+Cl2(g)=MgC12(s) ΔH=-641 kJ·mol-1
②Ti(s)+2C12(g)=TiCl4(s) ΔH=-770 kJ·mol-1
则2Mg(s)+TiCl4(s)=2MgCl2(s)十Ti(s) ΔH=________.
反应2Mg(s)+TiCl4(s)![]() 2MgCl2(s)+Ti(s)在Ar气氛中进行的理由是________.
2MgCl2(s)+Ti(s)在Ar气氛中进行的理由是________.
(4)以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池.该电池中负极上的电极反应式是________.
查看答案和解析>>
科目:高中化学 来源:模拟题 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:
钛被称为继铁、铝之后的第三金属。如下图所示,将钛厂、氯碱厂和甲醇厂组成产业链可以大大提高资源利用率,减少环境污染。
 请填写下列空白:
请填写下列空白:
(1)电解食盐水时,总反应的离子方程式是 。
(2)写出钛铁矿经氯化法得到四氯化钛的化学方程式:
。
(3)已知:①.Mg(s)+Cl2(g)=MgC12(s) △H=-641kJ·mol-1
②Ti(s)+2C12(g)=TiCl4(s) △H=-770kJ·mol-1
则2Mg(s)+TiCl4(s)=2MgCl2(s)十Ti(s) △H= 。
|
反应2Mg(s)+TiCl4(s) 2MgCl2(s)+Ti(s)在Ar气氛中进行的理由是
。
(4)以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。该电池中负极上的电极反应式是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com