
分析 (1)电池反应式为:Zn+Ag2O═ZnO+2Ag,根据化合价变化可知Zn被氧化,发生氧化反应,应为原电池的负极,结合电极方程式判断pH的变化;
(2)化学反应中,化学键的断裂需要吸收能量,形成新化学键放出能量,反应热等于反应物键能之和减去生成物的总键能之和.
解答 解:(1)原电池的负极发生氧化反应,化合价升高,锌银铅蓄电池发生的电池总反应为Ag2O+Zn═ZnO+2Ag,反应中Zn的化合价升高被氧化,应为原电池的负极,锌银电池中负极锌失电子,电极反应式:Zn+2OH--2e-=ZnO+H2O,Ag元素化合价降低,被还原,为正极反应,正极氧化银得电子,电极方程式为Ag2O+H2O+2e-=2Ag+2OH-,负极消耗OH-,则pH降低,正极生成OH-,则pH升高,
故答案为:Zn;减小;
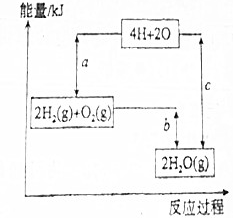
(2)反应2H2(g)+O2(g)=2H2O(g)的能量变化如图1所示.已知拆开1molH2、1molO2和1molH-O中的化学键分别需要消耗436KJ、498KJ和463KJ能量,
2molH2和1molO2参加反应断裂化学键吸收的能量为:2×436kJ+498kJ=1370kJ,即a值,
生成2molH2O(g)形成新化学键放出的能量为:4×463kJ=1852kJ,即C值,
反应的焓变△H=2×436KJ/mol+498KJ/mol-2×2×463KJ/mol=-482KJ/mol,即b值,
故答案为:1370KJ;-482KJ.
点评 本题考查了原电池、化学反应焓变的计算,为高频考点,侧重于学生的分析能力的考查,明确原电池原理、掌握反应热量与化学键的关系是解答本题关键,题目难度中等.


 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
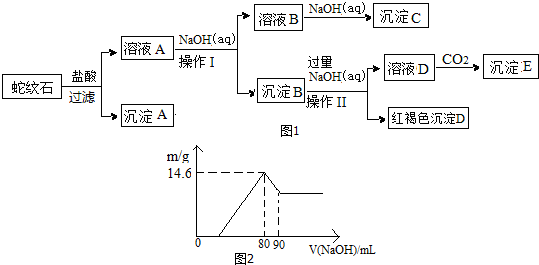
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 1.9 | 3.3 | 9.4 |
| 完全沉淀pH | 3.7 | 4.7 | 11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
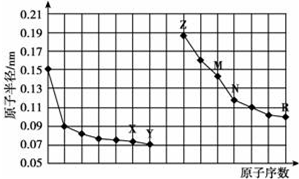
| A. | 简单离子的半径:X<Z<M | |
| B. | 最高价氧化物对应水化物的酸性:R<N | |
| C. | Y、R两种元素的气态氢化物稳定性:Y>R | |
| D. | 由X与N两种元素组成的化合物不能与任何酸反应,但能与强碱反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 铝片和稀盐酸反应 | B. | 氢氧化钡晶体和氯化铵反应 | ||
| C. | 灼热的碳与CO2反应 | D. | 甲烷在氧气中燃烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
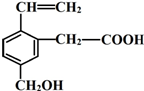 某有机物的结构简式如图,该物质不应有的化学性质是⑥⑦
某有机物的结构简式如图,该物质不应有的化学性质是⑥⑦查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入少量NaNO3溶液 | B. | 加入少量CuSO4溶液 | ||
| C. | 加入少量CH3COONa固体 | D. | 改用98%的浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com