
【题目】现有三组溶液(1)汽油和氯化钠溶液;(2)酒精和水的混合溶液;(3)氯化钠和单质溴的溶液;以上混合溶液分离的正确方法依次是( )
A.分液、萃取、蒸馏B.萃取、蒸馏、分液
C.分液、蒸馏、萃取D.蒸馏、萃取、分液
科目:高中化学 来源: 题型:
【题目】在无土栽培中,须配制一定量含50molNH4Cl、16molKCl和24molK2SO4的营养液。若用KCl、NH4Cl和(NH4)2SO4三种固体来配制,三者的物质的量依次是(单位:mol):
A.2、64、24B.64、2、24
C.32、50、12D.16、50、24
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣探究小组将一批废弃的线路板简单处理后,得到含Cu(70%)、Al(25%)、Fe(4%)及少量Au等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的流程: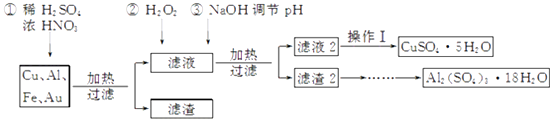
已知:Fe3+、Al3+、Cu2+开始沉淀至沉淀完全的pH范围分别为:2.2~3.2、4.1~5.0、5.3~6.6.
(1)得到滤渣1的主要成分为 .
(2)操作Ⅰ包含的实验步骤有:、冷却结晶、过滤、洗涤、干燥;过滤操作所用到的玻璃仪器有烧杯、玻璃棒和 .
(3)操作Ⅰ中常用无水乙醇对晶体进行洗涤,选用无水乙醇的原因是 .
(4)第②步加H2O2后发生反应的离子方程式为 .
(5)取上述硫酸铝晶体进行热重分析,其热分解主要分为三个阶段:323K~523K,553K~687K,当温度在1 043K以上不再失重,下表列出了不同温度下的失重率:[硫酸铝晶体化学式为Al2(SO4)318H2O,相对分子质量为666]
已知:失重%= ![]() ×100%.
×100%.
温度(K) | 失重(%) | |
第一阶段 | 323~523 | 40.54 |
第二阶段 | 553~687 | 48.65 |
第三阶段 | 1 043以上 | 84.68 |
通过计算确定(写出计算过程):
①失重第一阶段分解产物的化学式;
②失重第二阶段反应的反应化学方程式.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在AlCl3、MgCl2、MgSO4的混合溶液中,c(Al3+)=0.10mol/L,c(Mg2+)=0.25mol/L,c(Cl-)=0.50mol/L,则c(SO42-)为
A. 0.10mol/L B. 0.15mol/L C. 0.20mol/L D. 0.30mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的离子在强酸性水溶液里能大量共存的是
A. Ba2+、Na+、CO32-、NO3- B. K+、 CH3COO-、I-、Fe3+
C. Cu2+、Fe2+、SO42-、Cl- D. K+、Cl-、NO3-、HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁氧体是一类磁性材料,通式为MO·xFe2O3(M为二价金属离子),如Fe3O4可表示为FeO·Fe2O3,制备流程为:
![]()
根据题意回答:
(1)现称取2.8 g铁粉,加入一定量的稀硫酸使其完全溶解后,再加入_____g的FeCl3固体,经上述反应后,方可得到纯净的Fe3O4;
(2)如果以MgSO4和FeCl3为原料,要获得18.0克MgO·2Fe2O3,在制取过程中至少需要1 mol/L的NaOH溶液____mL;
(3)在一次制备Fe3O4的实验中,由于反应物比例控制不当,获得了另一种产品。取一定量该产品溶于足量盐酸中,还需通入标准状况下672 mLCl2才能把溶液中的Fe2+全部氧化为Fe3+,然后把所得溶液蒸干,灼烧至恒重,得9.6 g固体。该产品的化学式为_______;
(4)有一种在电子工业上应用广泛的含铬铁氧体,其组成可表示为:![]() ,现有15.2 g FeSO4,经Cr2O72-、H2O2等物质处理后(不再引入含铁物质),可得到含铬铁氧体的质量范围为___________________。
,现有15.2 g FeSO4,经Cr2O72-、H2O2等物质处理后(不再引入含铁物质),可得到含铬铁氧体的质量范围为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室在常温下将浓盐酸与高锰酸钾混合能够制氣气,反应的化学方程式为:2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O下列有关该反应的说法正确的是( )
A.KMnO4是还原剂
B.HCl是氧化剂
C.HCl中的氯元素得到电子
D.KMnO4中的Mn元素被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列题目
(1)现有以下物质 ① 酒精 ②盐酸 ③熔融KCl ④KOH固体 ⑤蔗糖 ⑥铜 ⑦稀H2SO4溶液
以上物质中属于电解质的是(填序号)________________
(2)同温同压下,同体积的CO2和CO,它们的分子数之比为____________ ,密度之比为_____________。
(3)向沸水中逐滴滴加1mol·L-1FeCl3溶液,至液体呈透明的红褐色,形成该分散系的微粒直径的范围是___________________。
(4)下列物质:①Cl2;②Na2CO3;③NaHCO3;④K—Na合金;⑤Na。
广泛用于玻璃、造纸的是______________(填编号,下同)
可用作原子反应堆的导热剂的是________________________。
(5)氯水具有多种性质,根据新制氯水分别与如图五种物质发生的反应填空(氯水足量):

上述反应中发生了氧化还原反应的是:________(填“a”、“b”、“c”或“e”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com