
| A. | 加入少量W,逆反应速率增大 | |
| B. | 通入一定量氦气,压强增大,平衡向正反应方向移动 | |
| C. | 升高温度,正反应速率增大,逆反应速率减小,平衡向正反应方向移动 | |
| D. | 降低温度,正反应速率减小,逆反应速率也减小,平衡向逆反应方向移动 |
分析 A.对于可逆反应,固体对反应速率没有影响;
B.通入氦气后,根据参加反应的气体的浓度是否变化判断平衡是否移动;
C.升高温度,正逆反应速率都增大;
D.该反应为吸热反应,降低温度,正反应和逆反应少量都会减小,平衡向放热方向移动.
解答 解:A.W是固体,加入少量的W对化学平衡无影响,故A错误;
B.恒容条件下通入惰性气体,参加反应的气体的浓度不变,平衡不移动,故B错误;
C.无论该反应是放热反应还是吸热反应,升高温度,正逆反应速率都增大,故C错误;
D.该反应是吸热反应,降低温度,正逆反应速率都减小,平衡向逆反应方向移动,故D正确;
故选D.
点评 本题考查了化学平衡的影响因素,题目难度不大,明确化学平衡及其影响为解答关键,易错选项是B,注意通入稀有气体后,根据参加反应的气体的浓度是否变化来判断平衡是否移动.


科目:高中化学 来源: 题型:推断题


 .
. ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;比较C和D的稳定性的强弱大小H2O>NH3(用化学式表示)
;比较C和D的稳定性的强弱大小H2O>NH3(用化学式表示)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
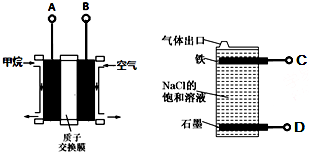
| A. | 燃料电池的A极连接电解池的C极 | |
| B. | 燃料电池工作时当0.2 NA个H+通过质子交换膜移向右边,饱和食盐水中可产生2.24L气体 | |
| C. | A电极的电极反应式为:CH4-8e-+2H2O═CO2+8H+ | |
| D. | 电解池总反应式为NaCl+H2O$\frac{\underline{\;电解\;}}{\;}$NaClO+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
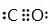 ,E与BD形成的化合物E(BD)5熔点253K,沸点376K,其固体属于分子晶体.
,E与BD形成的化合物E(BD)5熔点253K,沸点376K,其固体属于分子晶体.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
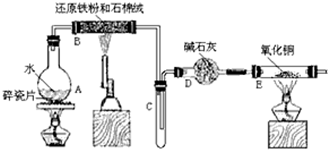
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新制氯水使有色布条褪色 | B. | 过氧化钠使某些染料褪色 | ||
| C. | 二氧化硫使品红溶液褪色 | D. | 活性炭使红墨水褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com