
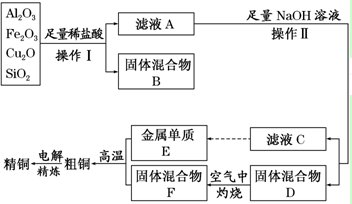
分析 某矿渣(含有Cu2O、Al2O3,Fe2O3、SiO2)加足量的稀盐酸,过滤,滤液A含有Cu2+、Al3+、Fe2+;固体混合物B为二氧化硅和Cu;滤液A中加足量的NaOH溶液,生成偏铝酸钠、氢氧化铁沉淀和氢氧化铜沉淀,过滤,滤液C为偏铝酸钠,偏铝酸钠经过一系列操作可以制得E(Al),固体混合物D为氢氧化铁沉淀和氢氧化铜沉淀,灼烧氢氧化铁沉淀和氢氧化铜沉淀得到固体混合物F(氧化铁和氧化铜),氧化铁和氧化铜混合物发生铝热反应生成Cu和Fe,电解得到纯铜.
(1)根据分离溶液和沉淀;根据灼烧过程所需要用到的仪器分析即可;
(2)依据提取流程图可知,加入过量盐酸,氧化铁和氧化铝全部溶解为氯化铁和氯化铝溶液,Cu2O与盐酸反应生成氯化铜、铜和水,生成的铜能与氯化铁反应生成氯化亚铁和氯化铜,二氧化硅不溶于盐酸为沉淀;三价铁离子与KSCN溶液发生反应生成红色物质来检验三价铁离子;
(3)根据铝热反应的原理来书写;
(4)设溶液的PH为X,然后求出由水电离出的c(OH-),利用由水电离出的c(OH-)前者为后者的108倍求出X;
(5)a.电能转化为化学能、热能;
b.粗铜接电源正极,失去电子,发生氧化反应
c.精铜作阴极,电解后电解液中Cu2+浓度减小
d.粗铜精炼时通过的电量与阴极析出铜的量存在关系;
(6)设计方案的主要步骤是将浓硫酸用蒸馏水稀释,将样品与稀硫酸充分反应后,过滤,干燥,称量剩余固体铜的质量即可.
解答 解:某矿渣(含有Cu2O、Al2O3,Fe2O3、SiO2)加足量的稀盐酸,过滤,滤液A含有Cu2+、Al3+、Fe2+;固体混合物B为二氧化硅和Cu;滤液A中加足量的NaOH溶液,生成偏铝酸钠、氢氧化铁沉淀和氢氧化铜沉淀,过滤,滤液C为偏铝酸钠,偏铝酸钠经过一系列操作可以制得E(Al),固体混合物D为氢氧化铁沉淀和氢氧化铜沉淀,灼烧氢氧化铁沉淀和氢氧化铜沉淀得到固体混合物F(氧化铁和氧化铜),氧化铁和氧化铜混合物发生铝热反应生成Cu和Fe,电解得到纯铜.
(1)实验操作I步骤中分离溶液和沉淀的操作名称为过滤,在空气中灼烧固体混合物D时,所用到的仪器有坩埚、泥三角、三角架、酒精灯,玻璃棒,
故答案为:过滤;坩埚;
(2)依据提取流程图可知,加入过量盐酸,氧化铁和氧化铝全部溶解为氯化铁和氯化铝溶液,Cu2O与盐酸反应生成氯化铜、铜和水,生成的铜能与氯化铁反应生成氯化亚铁和氯化铜,方程式为:2FeCl3+Cu═2FeCl2+CuCl2,二氧化硅不溶于盐酸为沉淀,所以滤液A中铁元素的存在形式为亚铁离子,可用氯水将其氧化成三价铁离子,三价铁离子与KSCN溶液发生反应生成红色物质来检验三价铁离子,
故答案为:Fe2+;2Fe3++Cu═2Fe2++Cu2+;硫氰化钾溶液和新制氯水;
(3)铝与氧化铁发生铝热反应的化学方程式为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3,故答案为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3;
(4)设溶液的PH为X,NaAlO2溶液中由水电离出的c(OH-)=10X-14mol/L,NaOH溶液中由水电离出的c(OH-)=10-Xmol/L,$\frac{1{0}^{X-14}}{1{0}^{-X}}$=108,解得X=11,
则溶液中氢离子浓度:c(H+)=10-11mol/L,即pH=11;
故答案为:11;
(5)a.电能部分转化为化学能,故a错误;
b.粗铜接电源正极,失去电子,发生氧化反应,故b正确;
c.精铜作阴极,电解后电解液中Cu2+浓度减小,故c正确;
d.粗铜精炼时通过的电量与阴极析出铜的量存在关系:电路中通过3.01×1023个电子,得到精铜的质量为16g,故d错误;
故选:b.c;
(6)设计方案的主要步骤是将浓硫酸用蒸馏水稀释,将样品与稀硫酸充分反应后,过滤,干燥,称量剩余固体铜的质量即可;
故答案为:将浓硫酸用蒸馏水稀释,将样品与稀硫酸充分反应.
点评 本题以矿渣(含有Cu2O、Al2O3、Fe2O3、SiO2)提取铜为背景,考查考查物质的制备以及分离和提纯等知识,侧重于考查学生综合运用化学知识的能力,为高考常见题型,难度中等.


 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案 激活思维优加课堂系列答案
激活思维优加课堂系列答案科目:高中化学 来源: 题型:选择题
 常温下,0.2mol•L-1NaHA 与等浓度等体积的 NaOH 溶液混合,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是( )
常温下,0.2mol•L-1NaHA 与等浓度等体积的 NaOH 溶液混合,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是( )| A. | NaHA 溶液显酸性 | B. | 混合溶液中 c(OH-)、c(H+)相等 | ||
| C. | 图中 X、Y、Z 分别代表 OH-、HA-、H+ | D. | 混合溶液中:c(Na+)═c(H2A)+c(HA-)+c(A2-) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 铁和稀硫酸反应:2Fe+6H+=2Fe3++3H2↑ | |
| B. | 少量NaHCO3溶液与Ca(OH)2溶液反应:OHˉ+HCO3ˉ+Ca2+=CaCO3↓+H2O | |
| C. | 钠和冷水反应:2Na+2H2O=2 Na++2OHˉ+H2↑ | |
| D. | 过量的CO2和氢氧化钙溶液的反应 OHˉ+CO32-=HCO3ˉ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3、P4、C10H8 | B. | PCl3、CO2、H2SO4 | C. | SO2、SiO2、P2O5 | D. | CCl4、H2O、Na2O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
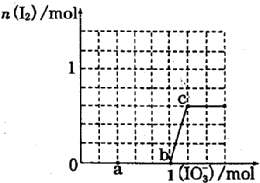 已知:还原性HSO3->I-,氧化性IO3->I2.在含3mol NaHSO3的溶液中逐滴加入NaIO3溶液.加入NaIO3的物质的量和和析出的I2的物质的量的关系曲线如图.下列说法正确的是( )
已知:还原性HSO3->I-,氧化性IO3->I2.在含3mol NaHSO3的溶液中逐滴加入NaIO3溶液.加入NaIO3的物质的量和和析出的I2的物质的量的关系曲线如图.下列说法正确的是( )| A. | 反应过程中的氧化产物均为Na2SO4 | |
| B. | a 点时消耗NaHSO3的物质的量为1.0mol | |
| C. | 0~b间的反应可用如下离子方程式表示:3HSO3-+IO3-=3SO42-+I-+3H+ | |
| D. | 当溶液中I-与I2的物质的量之比为5:3时,加入的NaIO3为1.1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 乙酸是食醋的主要成分,它具有以下化学性质:
乙酸是食醋的主要成分,它具有以下化学性质:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
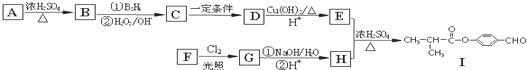
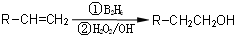
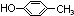 .
. .
.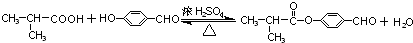 .
.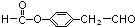 (邻、间、对任写一种即可).
(邻、间、对任写一种即可).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 仅有实验①可推出肯定含有SO42-,不含Cl- | |
| B. | 该无色溶液肯定含有NH4+、K+、Al3+、SO42- | |
| C. | 该无色溶液中肯定不含K+、Mg2+、HCO3-、Cl-、MnO4-、I- | |
| D. | 不能确定该无色溶液是否含有K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 32g O2 | B. | 0.2mol N2 | ||
| C. | 3.01×1023个CO2分子 | D. | 标准状况下11.2L H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com