
| 沉淀物 | 开始沉淀时的pH | 完全沉淀时的pH |
| Al(OH)3 | 3.8 | 5.2 |
| Fe(OH)3 | 2.7 | 3.2 |
| Fe(OH)2 | 7.6 | 9.7 |
| Ni(OH)2 | 7.1 | 9.2 |
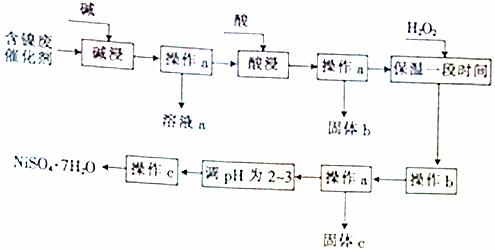
分析 由流程可知,某化工厂的含镍催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%).碱浸过滤得到固体加入酸浸过滤加入过氧化氢氧化亚铁离子为铁离子,调节溶液PH使铁离子和铝离子全部沉淀,镍离子不沉淀,过滤后调节溶液PH2-3防止镍离子水解,通过蒸发浓缩,冷却结晶,过滤洗涤得到NiSO4•7H2O晶体;
(1)依据流程图分析判断,操作a是过滤得到固体和滤液,c是蒸发浓缩得到晶体过滤得到NiSO4•7H2O;
(2)含镍催化剂主要含有Ni,还含有Al(31%)的单质及氧化物,铝和氧化铝都可以和强酸强碱反应溶解得到溶液含有偏铝酸盐;
(3)依据最后制备NiSO4•7H2O,防止引入其他杂志离子需要加入硫酸进行溶解;铁及其化合物、镍和硫酸反应生成亚铁离子和镍离子,过滤后得到溶液为硫酸亚铁和硫酸镍溶液;
(4)依据氢氧化物沉淀的PH分析判断,加入过氧化氢氧化亚铁离子为铁离子后,调节溶液pH使铁离子全部沉淀,镍离子不沉淀得到较纯净的硫酸镍溶液;
(5)①过滤a得到滤液a为偏铝酸钠溶液,和过量盐酸反应生成氯化铝;
②根据题意结合原子守恒、电荷守恒可得生成[AlO4Al12(OH)24(H2O)12]7+的离子方程式.
解答 解:(1)操作a是过滤得到固体和滤液,c是蒸发浓缩得到晶体过滤得到NiSO4•7H2O;,操作a、c中需使用的仪器除铁架台(带铁圈)、酒精灯、烧杯、玻璃棒外还需要的主要仪器为过滤装置中的漏斗和蒸发浓缩溶液需要的蒸发皿,
故答案为:漏斗、蒸发皿;
(2)“碱浸”过程中是为了除去铝及其氧化物,铝是两性元素和强碱反应,氧化铝是两性氧化物和强碱反应,镍单质和铁及其氧化物不和碱反应达到除去铝元素的目的;反应的两种方程式为:2Al+2OH-+2H2O═2AlO2-+3H2↑、Al2O3+2OH-═2AlO2-+3H2O,
故答案为:2Al+2OH-+2H2O═2AlO2-+3H2↑、Al2O3+2OH-═2AlO2-+H2O;
(3))“酸浸”时主要是溶解镍金属和铁单质及其氧化物,依据制备目的是得到NiSO4•7H2O,加入的酸不能引入新的杂质,所以需要加入硫酸进行酸浸;镍、铁和稀硫酸反应生成硫酸亚铁、硫酸镍溶液,
故答案为:H2SO4;
(4)依据图表中沉淀需要的溶液pH,加入过氧化氢氧化亚铁离子为铁离子后,调节溶液pH使铁离子全部沉淀,镍离子不沉淀得到较纯净的硫酸镍溶液,pH应在3.2-7.1间,故答案为:3.2-7.1;
(5)①过滤a得到滤液a为偏铝酸钠溶液,和过量盐酸反应生成氯化铝,反应的离子方程式为:AlO2-+4H+=Al3++2H2O,故答案为:AlO2-+4H+=Al3++2H2O;
②向1.0mo!•L-1 AlCl3溶液中加入0.6mol•L-1的NaOH溶液,可制得Alb含量约为86%的聚合氯化铝溶液,根据题意结合原子守恒、电荷守恒可得生成[AlO4Al12(OH)24(H2O)12]2+,反应的离子方程式为:13Al3++OH-+H2O=[AlO4Al12(OH)24(H2O)12]7+,
故答案为:13Al3++32OH-+8H2O=[AlO4Al12(OH)24(H2O)12]7+.
点评 本题考查了物质分离的实验设计和方法应用,主要是利用溶液不同PH条件下离子沉淀的情况不同,控制溶液PH除去杂质离子,得到较纯净的硫酸镍溶液来制备硫酸镍晶体,同时考查了除杂原则不能引入新的杂质,铝及其化合物性质分析判断,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 2-戊烯的同分异构体数目为五种 | |
| B. | 丙烯与HCl加成产物是1-氯丙烷 | |
| C. | 组成为CnH2n的烃,当n=4时,才具有同分异构体 | |
| D. | 能使溴水或酸性KMnO4溶液褪色的C4H8的物质可能有三种 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 美国梅奥诊所的研究人员发现,绿茶中含有EGCG(表没食子儿茶素没食子酸酯)物质具有抗癌作用,能使血癌(白血病)中癌细胞自杀性死亡,已知EGCG的结构式为:有关EGCG的说法错误的是( )
美国梅奥诊所的研究人员发现,绿茶中含有EGCG(表没食子儿茶素没食子酸酯)物质具有抗癌作用,能使血癌(白血病)中癌细胞自杀性死亡,已知EGCG的结构式为:有关EGCG的说法错误的是( )| A. | EGCG能与碳酸钠溶液反应放出二氧化碳 | |
| B. | EGCG遇FeCl3溶液能发生显色反应 | |
| C. | 1molEGCG最多可与含10mol NaOH的溶液完全作用 | |
| D. | EGCG在空气中易氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 仅在O2中 | B. | 仅在NO2中 | C. | 仅在O2和NO2中 | D. | 平衡体系中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)某同学做如下实验,以检验反应中的能量变化.
(1)某同学做如下实验,以检验反应中的能量变化.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
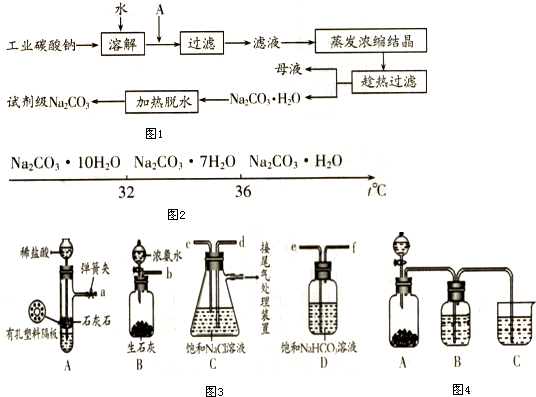
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 )与两个烃基相连的化合物叫酮(如丙酮 ).下列醇能发生脱氢氧化,但不可能得到醛类化合物的是( )
)与两个烃基相连的化合物叫酮(如丙酮 ).下列醇能发生脱氢氧化,但不可能得到醛类化合物的是( )| A. | CH3CH2CH2OH | B. | 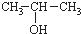 | C. | 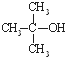 | D. | 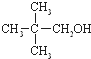 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 回答下列问题:
回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com