
 .
. 分析 (1)由信息可知,Vitc使Fe3+转化为Fe2+,Fe元素的化合价降低,则Vitc中某元素的化合价升高;
(2)发生3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$3CO2+2Fe,该反应转移6e-,以此来解答.
解答 解:(1)由信息可知,Vitc使Fe3+转化为Fe2+,Fe元素的化合价降低,则Vitc中某元素的化合价升高,则Vitc在这一过程中做还原剂,具有还原性,
故答案为:还原;还原;
(2)发生3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$3CO2+2Fe,三氧化二铁中,铁化合价由+3降低为0价得3个电子;CO中C由+2价升高为+4价失2个电子,由得失电子总数相等可知转移电子总数为6e-,用单线桥法表明电子的转移为 ,故答案为:
,故答案为: .
.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | BaCl2溶液和盐酸 | B. | BaCl2溶液、盐酸、澄清石灰水 | ||
| C. | BaCl2溶液、AgNO3溶液 | D. | BaCl2溶液、盐酸、品红溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气的水溶液能导电,所以氯气是电解质 | |
| B. | 干燥的氯气无漂白性,液氯具有极强的漂白性 | |
| C. | 氯气能使紫色石蕊溶液先变红后褪色 | |
| D. | 铜在氯气中燃烧生成红棕色烟 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验及现象 | 结论 |
| A | 将湿润的红色石蕊试纸放在试管口,试纸变蓝 | 反应中有NH3产生 |
| B | 收集产生的气体并点燃,火焰呈淡蓝色 | 反应中有H2产生 |
| C | 收集气体的同时测得溶液的pH为8.0 | 弱碱性溶液中Mg也可被氧化 |
| D | 将光亮的镁条放入pH为8.6的NaHCO3溶液中,有气泡产生 | 弱碱性溶液中OH-氧化了Mg |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
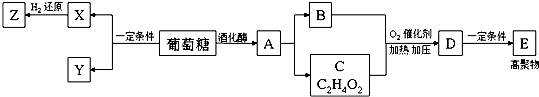
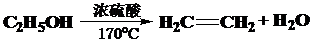 .
.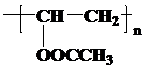 .
.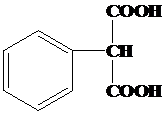 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纤维素乙酸酯、油脂和蛋白质都是能发生水解反应的高分子化合物 | |
| B. | 蔗糖、淀粉、油脂及其水解产物均为非电解质 | |
| C. | 若两种二肽互为同分异构体,则两者的水解产物不一致 | |
| D. | 蛋白质溶液能发生丁达尔现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只要不加入其他物质,液氨中c(NH4+ )总是等于c(NH2- ) | |
| B. | 一定温度下,c(NH4+ )×c(NH2- )为常数 | |
| C. | 其他条件不变,增加液氨的量,电离平衡正向移动 | |
| D. | 维持温度不变,向液氨中加入少量氯化铵固体,c(NH2-)将减少 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知X、Y和Z三种元素的原子序数之和等于48.X是有机物主要组成元素.X的一种1:1型气态氢化物分子中既有σ键又有π键.Z是金属元素,Z的核电荷数小于28,且次外层有2个未成对电子.
已知X、Y和Z三种元素的原子序数之和等于48.X是有机物主要组成元素.X的一种1:1型气态氢化物分子中既有σ键又有π键.Z是金属元素,Z的核电荷数小于28,且次外层有2个未成对电子.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 化工厂生产盐酸的主要过程是:
化工厂生产盐酸的主要过程是:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com