
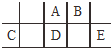
 短周期元素A、B、C、D、E在元素周期表中的相对位置如图所示,其中D原子的质子数是其M层电子数的三倍,下列说法不正确的是( )
短周期元素A、B、C、D、E在元素周期表中的相对位置如图所示,其中D原子的质子数是其M层电子数的三倍,下列说法不正确的是( )| A. | A有5种正价,与B可形成6种化合物 | |
| B. | 工业上常通过电解熔融态C2B3的方法来获得C的单质 | |
| C. | 简单离子的半径由大到小为:E>A>B>C | |
| D. | D、E两元素形成的化合物每种原子最外层都达到了8e-稳定结构 |
分析 D原子的质子数是其M层电子数的三倍,则D的质子数为15,最外层电子数为5,应为P元素,由元素在周期表中的位置可知A为N元素,B为O元素,C为Al元素,E为Cl元素,以此解答该题.
解答 解:D原子的质子数是其M层电子数的三倍,则D的质子数为15,最外层电子数为5,应为P元素,由元素在周期表中的位置可知A为N元素,B为O元素,C为Al元素,E为Cl元素,
A.A为N元素,元素正化合价有+1、+2、+3、+4、+5价,每一种化合价都对应氧化物,其中+4价有2种,共6种,故A正确;
B.工业用电解氧化铝的方法冶炼铝,故B正确;
C.A、B、C对应的离子具有相同的核外电子排布,核电荷数越大离子半径越小,核素电子层数越多,离子半径越大,故C正确;
D.D、E两元素形成的PCl5中P原子的最外层没有达到了8e-稳定结构,而是10个,故D错误.
故选D.
点评 本题主要是元素“位、构、性”三者关系的综合考查,比较全面考查学生有关元素推断知识,侧重于学生的分析能力的考查,为高考常见题型,难度中等,注意把握原子结构与元素周期律的递变规律.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用氯化铁溶液腐蚀铜板:Cu+Fe3+═Cu2++Fe2+ | |
| B. | 碘水中通入适量的SO2:I2+SO2+2H2O═2I-+SO42-+4H+ | |
| C. | 硝酸银溶液中滴加过量氨水:Ag++NH3•H2O═AgOH↓+NH4+ | |
| D. | 0.5mol/LNaHSO4与0.5mol/LBa(OH)2混合至溶液呈中性:Ba2++OH-+SO42-+H+═BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 50℃时,测定某NaNO2溶液的pH=8,则溶液中c(Na+)-c(NO2-)=9.9×10-7mol•L-1 | |||||||||
| B. | NaHSO3水溶液中存在关系:c(H2SO3)+c(H+)=c(OH-)+c(SO32-)+c(HSO3-) | |||||||||
| C. | 一定温度下,利用pH计测定不同浓度醋酸溶液的pH值,得到如下数据:
| |||||||||
| D. | 已知25℃时,有关弱电解质的电离平衡常数:HCN:Ka=4.9×10-10;H2CO3:Ka1=4.3×10-7Ka2=5.6×10-11.则CO2通入NaCN溶液中反应的化学方程式为:2NaCN+H2O+CO2=2HCN+Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 金刚石网状结构中,由共价键形成的碳原子环中,最小的环上有6个碳原子 | |
| B. | 氯化钠晶体中,每个Na+周围距离相等且最近的Na+共有6个 | |
| C. | 金属晶体中,铜和锌都是面心立方堆积 | |
| D. | 干冰晶体中,每个CO2分子周围距离相等且最近的CO2分子共有12个 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
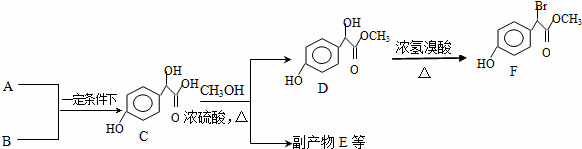
 .
.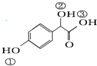 )中①、②、③(从左到右编号)3个-OH的酸性由弱到强的顺序是:③>①>②.
)中①、②、③(从左到右编号)3个-OH的酸性由弱到强的顺序是:③>①>②.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
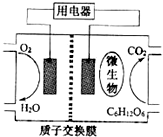
| A. | 该电池能够在高温下工作 | |
| B. | 电池的负极反应为:C6H12O6+6H2O-24e-═6CO2+24H+ | |
| C. | 放电过程中,质子(H+)从负极区向正极区迁移 | |
| D. | 在电池反应中,每消耗1mol氧气,理论上能生成标准状况下CO2气体22.4 L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;D元素在元素周期表中的位置为第四周期第Ⅷ族
;D元素在元素周期表中的位置为第四周期第Ⅷ族查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属Cu的晶体的配位数为12 | |
| B. | 金属键是金属阳离子与自由电子间的相互作用 | |
| C. | 金属的延展性可以用电子气理论解释 | |
| D. | 金属Mg、Zn、Ti都是六方最密堆积,空间利用率是68% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com