
分析 (1)氰化钠为强碱弱酸盐,水解生成氢氰酸和氢氧化钠,溶液呈碱性;
(2)①使湿润的红色石蕊试纸变蓝的气体为氨气,根据原子守恒,同时生成碳酸氢钠;
②根据原子守恒和电荷守恒解答;
(3)①非金属性强的元素显示负价,非金属性弱的则显示正价;
②根据信息:CN-能够被氧气氧化成HCO3-,同时生成NH3来书写方程式;
③A.该电解质溶液呈碱性,电解时,用不活泼金属或导电非金属作阳极,可以用较活泼金属作阴极;
B.阳极上氯离子失电子生成氯气,氯气和氢氧根离子反应生成次氯酸根离子和水;
C.阴极上水失电子生成氢气和氢氧根离子;
D.阳极产生的ClO-将CN-氧化为两种无污染的气体,该反应在碱性条件下进行,所以应该有氢氧根离子生成;
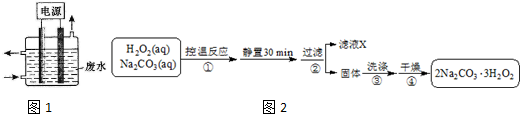
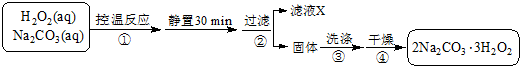
(4)双氧水和碳酸钠混合控制温度发生反应2Na2CO3 (aq)+3H2O2 (aq)?2Na2CO3•3H2O2(s),静置过滤得到固体2Na2CO3•3H2O2,将固体洗涤、干燥得到较纯净的2Na2CO3•3H2O2.
①过碳酸钠相当于带结晶双氧水的碳酸钠,具有双氧水的性质,催化剂、还原性物质易促进过碳酸钠反应而导致失效;
②先写出反应的化学方程式,然后根据双氧水与高锰酸钾的物质的量关系计算出样品中双氧水的百分含量.
解答 解:(1)氰化钠为强碱弱酸盐,水解反应为:CN-+H2O?HCN+OH-,溶液呈碱性,故答案为:CN-+H2O?HCN+OH-;
(2)①用双氧水处理氰化钠,产生一种能使湿润的红色石蕊试纸变蓝的气体为氨气,根据原子守恒一种酸式盐为碳酸氢钠,所以反应为:NaCN+H2O2+H2O═NaHCO3+NH3↑,
故答案为:NaCN+H2O2+H2O═NaHCO3+NH3↑;
②CN-+S2O32-═A+SO32-,根据电荷守恒,A为-1价的阴离子,根据原子守恒,A中含有1个硫原子、1个碳原子、1个氮原子,所以A为:SCN-,
故答案为:SCN-;
(3)①CN-中C元素显+2价,N元素显-3价,说明N非金属性强,故答案为:>;
②CN-能够被氧气氧化成HCO3-,同时生成NH3得出方程式为:2CN-+4H2O+O2$\frac{\underline{\;微生物\;}}{\;}$2HCO3-+2NH3,故答案为:2CN-+4H2O+O2$\frac{\underline{\;微生物\;}}{\;}$2HCO3-+2NH3;
③A.该电解质溶液呈碱性,电解时,用不活泼金属或导电非金属作阳极,可以用较活泼金属作阴极,所以可以用石墨作阳极、铁作阴极,故A正确;
B.阳极上氯离子失电子生成氯气,氯气和氢氧根离子反应生成次氯酸根离子和水,所以阳极反应式为Cl-+2OH--2e-═ClO-+H2O,故B正确;
C.电解质溶液呈碱性,则阴极上水失电子生成氢气和氢氧根离子,电极反应式为2H2O+2e-═H2↑+2OH-,故C正确;
D.阳极产生的ClO-将CN-氧化为两种无污染的气体,两种气体为二氧化碳和氮气,该反应在碱性条件下进行,所以应该有氢氧根离子生成,反应方程式为2CN-+5ClO-+H2O═N2↑+2CO2↑+5Cl-+2OH-,故D错误;
故答案为:D;
(4)①过碳酸钠相当于带结晶双氧水的碳酸钠,具有双氧水的性质,FeCl3能作双氧水分解的催化剂,KCN具有还原性,能被过碳酸钠氧化,CuSO4催化双氧水的分解,硅酸钠不与过碳酸钠反应,
故答案为:C;
②高锰酸钾溶液与过碳酸钠反应的化学方程式为:6KMnO4+5(2Na2CO3•3H2O2)+19H2SO4═3K2SO4+6MnSO4+10Na2SO4+10CO2↑+15O2↑+34H2O,滴定过程中消耗2.000x10-2 mol•L-1 KMnO4标准溶液的物质的量为:2.000x10-2 mol•L-1×0.03L=6.000x10-4mol,
设过氧化氢的质量为xg,根据关系式
KMnO4~2Na2CO3•3H2O2~15H2O2
6mol 15×34g
6.000x10-4mol x
x=0.051
过氧化氢的质量分数=$\frac{0.051g}{0.2g}$=25.50%
故答案为:25.50%.
点评 本题考查了过碳酸钠的实验方案、化学方程式书写、物质质量分数的计算等知识,题目难度较大,注意化学实验原理,能够根据反应方程式进行简单的化学计算,试题培养了学生的分析、理解能力及灵活应用所学知识的能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,16 gO2中含有的氧分子数为NA | |
| B. | 1 molOH-中含有的电子数为10NA | |
| C. | 标准状况下,11.2 L H2O中含有的氢原子数为NA | |
| D. | 1 mol/LBaCl2溶液中含有的钡离子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NiOOH | B. | Ni(OH)2 | C. | Cd | D. | Cd(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 9.02g | B. | 8.26g | C. | 8.61g | D. | 7.04g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纯净物都是由同种分子构成 | |
| B. | 纯净物可能是单质,也可能是化合物 | |
| C. | 矿泉水是纯净物 | |
| D. | 纯净物就是由同种元素组成的物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3+ | B. | Fe2+ | C. | Al3+ | D. | Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com