
| A. | 该烃的分子式为C7H8 | |
| B. | 该烃的含碳量大于乙烯的含碳量 | |
| C. | 该烃一氯代物有5种 | |
| D. | 该烃在光照或催化剂作用下能和氯气发生取代反应 |
分析 A.石灰水共增重38g,为燃烧生成的二氧化碳与水的质量,70g沉淀为碳酸钙的质量.有机物中的碳全部转化为二氧化碳、氢全部转化为水,计算二氧化碳、水的物质的量,进而计算C元素、H元素的质量,根据原子守恒计算有机物的分子式;
B.乙烯的最简式为CH2,把C7H8的分子式转化成碳原子数为1的式子,H原子数目越大含碳量越低;
C.根据等效氢判断,分子中有几种不同的H原子,其一氯代物就有几种;
D.甲苯在光照条件下发生甲基上的取代,在催化剂作用下能和氯气等物质发生苯环上的取代反应.
解答 解:A.70g沉淀为CaCO3,其物质的量为$\frac{70g}{100g/mol}$=0.7mol,根据碳元素守恒可知,产生的二氧化碳为0.7mol,二氧化碳的质量为0.7mol×44g/mol=30.8g,其中碳元素质量为:0.7mol×12g/mol=8.4g,
石灰水增重38g,所以有机物燃烧生成的水的质量为:38g-30.8g=7.2g,物质的量为$\frac{7.2g}{18g/mol}$=0.4mol;氢元素质量为0.4mol×2×1g/mol=0.8g,
有机物中碳、氢原子的物质的量之比为0.7mol:0.4mol×2=7:8:1,即最简式为C7H8,为芳香烃,该烃的分子式为C7H8,故A正确;
B.乙烯的最简式为CH2,把C7H8的分子式转化成碳原子数为1的式子为$C{H}_{\frac{8}{7}}$,H原子数目越大含碳量越低,则该烃的含碳量大于乙烯的含碳量,故B正确;
C.C7H8为甲苯,分子中含有4种氢原子,的一氯代物有4种:苯环上邻、间、对位各一种;甲基上一种,故C错误;
D.甲苯与氯气光照时甲基上H被取代,在催化剂作用下能和氯气、硝酸发生苯环上的取代反应,故D正确;
故选C.
点评 本题考查有机物分子式的确定,题目难度中等,注意掌握燃烧法根据守恒思想确定有机物分子式,注意甲苯的性质.


 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:解答题
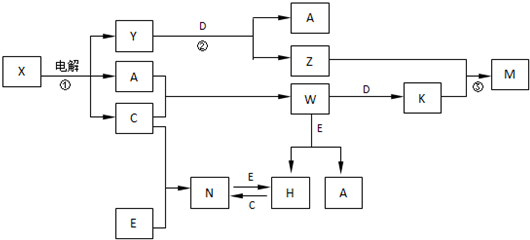
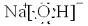 ,构成E单质的元素在周期表中位于第四周期第Ⅷ族.
,构成E单质的元素在周期表中位于第四周期第Ⅷ族.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.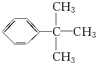 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
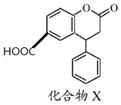
| A. | 分子中两个苯环一定处于同一平面 | |
| B. | 不能与饱和NaHCO3溶液反应 | |
| C. | 化合物X可以由 和 和 通过酯化反应得到 通过酯化反应得到 | |
| D. | 1 mol化合物X最多能与3 molNaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;该催化氧化反应的化学方程式为2CH3CH(OH)CH2CH3+O2 $→_{△}^{Cu}$ 2CH3COCH2CH3+2H2O.
;该催化氧化反应的化学方程式为2CH3CH(OH)CH2CH3+O2 $→_{△}^{Cu}$ 2CH3COCH2CH3+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 32gO2和O3的混合物中,所含氧原子数为2NA | |
| B. | 标准状况下,22.4LCl2与水反应,转移电子数为2NA | |
| C. | 标准状况下,3.36L辛烷中,所含碳原子数为1.5NA | |
| D. | 含1molFeCl3的饱和溶液,逐滴加入沸水中,完全形成Fe(OH)3胶体,胶粒数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
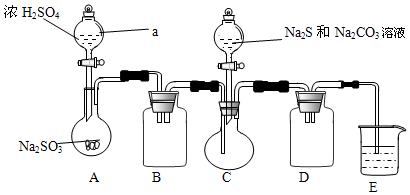
| 实验操作 | 现象 | 结论 |
| 取适量产品配成稀溶液,滴加足量BaCl2溶液 | 有白色沉淀生成 | |
| 过滤,用蒸馏水洗涤沉淀,向沉淀中加入足量稀HCl | 沉淀部分溶解,并有刺激性气味的气体产生 | 确定产品中含有Na2SO3和Na2SO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com