
| A. | 1 mol H2O含有的原子数为NA | |
| B. | 4g H2含有氢分子数4NA | |
| C. | 1L 0.1 mol•L-1NaCl溶液中含Na+数0.1NA | |
| D. | 常温常压下,11.2L O2中含有分子数为0.5NA |
分析 A、水分子是由2个氢原子和一个氧原子构成;
B、计算氢气物质的量结合阿伏加德罗常数计算分子数;
C、溶质物质的量n=CV,氯化钠完全电离分析;
D、标准状况气体摩尔体积为22.4L/mol.
解答 解:A、1 mol H2O含有的原子数为3NA,故A错误;
B、4g H2物质的量=$\frac{4g}{2g/mol}$=2mol,含有氢分子数2NA,故B错误;
C、1L 0.1 mol•L-1NaCl溶液中溶质物质的量n=CV=1L×0.1mol/L=0.1mol,含Na+数0.1NA,故C正确;
D、常温常压下,11.2L O2中物质的量不是0.5mol,故D错误.
故选C.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,阿伏加德罗常数是高考的“热点”,既考查了学生对物质的量、粒子数、质量、体积等与阿伏加德罗常数关系的理解,又可以涵盖多角度的化学知识内容.准确弄清分子、原子、原子核内质子中子及核外电子的构成关系是关键,题目较简单.


科目:高中化学 来源: 题型:多选题
| A. | 氢氧化铝可以用做耐火材料 | |
| B. | 铝热反应能放出大量的热,常用于焊接钢轨等 | |
| C. | 铝合金具有密度大、强度高且有一定的抗腐蚀能力,可用于制造能承受强磨损的构件 | |
| D. | 铜被誉为“21世纪的金属”,其应用前景更为广阔 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
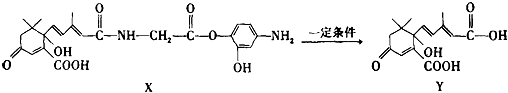
| A. | X可以发生氧化、取代、酯化、加聚、缩聚反应,并能与盐酸反应生成有机盐 | |
| B. | Y既可以与FeCl3溶液发生显色反应,又可使酸性KMnO4溶液褪色 | |
| C. | 1mol X与足量NaOH溶液反应,最多消耗4mol NaOH | |
| D. | X结构中有2个手性碳原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第七周期0族 | B. | 第八周期第ⅠA族 | C. | 第六周期第ⅡA族 | D. | 第七周期第ⅦA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钠溶液盛装在用橡胶塞的试剂瓶中 | |
| B. | 氢氟酸盛装在细口玻璃瓶中 | |
| C. | 硫酸亚铁溶液存放在加有少量铁粉的试剂瓶中 | |
| D. | 金属钠保存在石蜡油或煤油中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸溶液的pH=a,将此溶液加水稀释后,溶液中各微粒浓度均减小 | |
| B. | 将浓度均为0.01 mol•L-1的CH3COOH和CH3COONa溶液等体积混合后,溶液中:c(CH3COOH)+c(CH3COO-)=0.01mol•L-1 | |
| C. | 将等体积,pH值均为3的醋酸和盐酸,分别加水稀释至amL和bmL,稀释后溶液的pH值均为5,则b>a=100 | |
| D. | 一定温度下,向0.1mol•L-1的醋酸溶液中加少量烧碱,溶液中$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$的比值增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
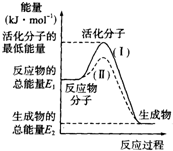 (1)在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子.使普通分子变成活化分子所需要提供的最低限度的能量叫活化能,其单位通常用kJ•mol-1表示.请认真观察下图,然后回答问题.
(1)在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子.使普通分子变成活化分子所需要提供的最低限度的能量叫活化能,其单位通常用kJ•mol-1表示.请认真观察下图,然后回答问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4HSO3溶于少量的NaOH溶液中:HSO3-+OH-═SO32-+H2O | |
| B. | 向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- | |
| C. | 硫化亚铁溶于稀硝酸中:FeS+2H+═Fe2++H2S↑ | |
| D. | 在NaHSO4溶液中滴加Ba(OH)2至中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 给试管中的铜与浓硫酸加热,发现试管底部有白色固体并夹杂有少量黑色物质,此白色固体为硫酸铜,黑色固体为氧化铜 | |
| B. | 浓硝酸在光照条件下变黄,说明浓硝酸不稳定,生成的有色产物能溶于浓硝酸 | |
| C. | 相同质量的铜分别与足量的等体积的浓硝酸和稀硝酸反应,生成溶液分别为绿色和蓝色,是由于反应时产生的铜离子浓度前者大于在后者 | |
| D. | 将铜片放入浓硫酸中,无明显实验现象,说明铜在冷的浓硫酸中发生钝化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com