Ⅰ.已知A、B、C、D四种分子所含原子的数目依次为1、3、6、6,且都含有18个电子,B、C是由两种元素的原子组成,且分子中两种原子的个数比均为1:2.D是一种有毒的有机物.
(1)组成A分子的原子的元素符号是
Ar
Ar
;
(2)从B分子的立体结构判断,该分子属于
极性
极性
分子(填“极性”或“非极性”);
(3)C分子中都包含
5
5
个σ键,
1
1
个π键.
(4)D的熔、沸点比CH
4的熔、沸点高,其主要原因是(须指明D是何物质):
D是CH3OH,分子之间能形成氢键
D是CH3OH,分子之间能形成氢键
.
Ⅱ.CO的结构可表示为C≡O,N
2的结构可表示为N≡N.
(5)下表是两者的键能数据:(单位:kJ/mol)
|
A-B |
A=B |
A≡B |
| CO |
357.7 |
798.9 |
1071.9 |
| N2 |
154.8 |
418.4 |
941.7 |
结合数据说明CO比N
2活泼的原因:
CO中第一个π键的键能是273kJ/mol,N2中第一个π键的键能是523.3kJ/mol,CO中第一个π键的键能较小,所以CO的第一个键比N2更容易断
CO中第一个π键的键能是273kJ/mol,N2中第一个π键的键能是523.3kJ/mol,CO中第一个π键的键能较小,所以CO的第一个键比N2更容易断
.
Ⅲ.Fe、Co、Ni、Cu等金属能形成配合物与这些金属原子的电子层结构有关.
(6)基态Ni原子的核外电子排布式为
1s22s22p63s23p63d84s2
1s22s22p63s23p63d84s2
,基态Cu原子的价电子排布式为
3d104s1
3d104s1
.
(7)Fe(CO)
5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)
5晶体属于
分子晶体
分子晶体
(填晶体类型).




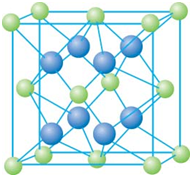 已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大.A与其他4种元素既不在同一周期又不在同一主族.B和C属同一主族,D和E属同一周期,又知E是周期表中1-18列中的第7列元素.D的原子序数比E小5,D跟B形成的晶体其晶胞结构如图,图中小球代表D,大球代表B.请回答:
已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大.A与其他4种元素既不在同一周期又不在同一主族.B和C属同一主族,D和E属同一周期,又知E是周期表中1-18列中的第7列元素.D的原子序数比E小5,D跟B形成的晶体其晶胞结构如图,图中小球代表D,大球代表B.请回答: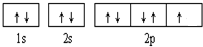


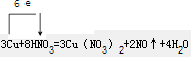
 A~I分别表示中学化学中常见的一种物质,它们之间相互转化关系如图所示(部分反应物、生成物没有列出),且已知A、B、C、D、E、F六种物质中均含同一种元素,A、I是两种常见的金属单质.H在常温下是一种常见的非金属气态单质.
A~I分别表示中学化学中常见的一种物质,它们之间相互转化关系如图所示(部分反应物、生成物没有列出),且已知A、B、C、D、E、F六种物质中均含同一种元素,A、I是两种常见的金属单质.H在常温下是一种常见的非金属气态单质.