
| A. | 不可能显碱性 | B. | 不可能显中性 | ||
| C. | 不可能显酸性 | D. | 可能中性、碱性、酸性 |
分析 若酸为强酸,则和pH=11的氢氧化钠溶液恰好完全反应,生成强酸强碱盐;
若酸为弱酸,则酸过量,得到的是过量和酸和生成的强碱弱酸盐的混合溶液,根据电离大于水解来分析.
解答 解:pH=3的某酸溶液中,氢离子的浓度为10-3mol/L,pH=11的氢氧化钠溶液中,氢氧根的浓度为10-3mol/L.
若酸为强酸,则pH=3的强酸和pH=11的氢氧化钠溶液等体积混合时恰好完全反应,生成强酸强碱盐,故溶液显中性;
若酸为弱酸,则酸没有完全电离,故酸过量,得到的溶液是过量和酸和生成的强碱弱酸盐的混合溶液,由于酸的电离程度通常大于盐的水解程度,故溶液显酸性.
综上分析可知,所得的溶液可能显中性也可能显酸性,但不能显碱性,故选A.
点评 本题考查了酸碱混合后溶液的酸碱性的分析,应注意根据酸的强弱来讨论,难度不大,应注意的是一般情况下,没有特殊说明时,认为酸的电离程度大于盐的水解程度.


 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:选择题
| A. | 放电时的负极反应为:PbO2+4H++2e-=Pb2++2H2O | |
| B. | 充电时,当阳极质量增加23.9 g时,溶液中有0.2 mol电子通过 | |
| C. | 放电时,正极区pH增大 | |
| D. | 充电时,Pb电极与电源的正极相连 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
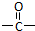 ”相连的碳原子上的氢活性较大,可以与甲醛或卤代烃等发生反应.
”相连的碳原子上的氢活性较大,可以与甲醛或卤代烃等发生反应.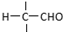 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$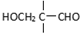
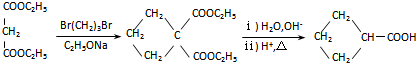
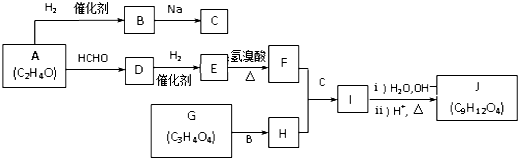
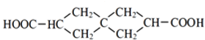 .J的同分异构体X属于芳香族化合物,1mol X分别与足量Na或NaOH反应时的物质的量之比是1:4和1:1,且苯环上只有一种一氯代物.写出符合上述所有条件的X的一种结构简式
.J的同分异构体X属于芳香族化合物,1mol X分别与足量Na或NaOH反应时的物质的量之比是1:4和1:1,且苯环上只有一种一氯代物.写出符合上述所有条件的X的一种结构简式 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 形成尿酸钠晶体的反应为放热反应 | B. | 形成尿酸钠晶体的反应为吸热反应 | ||
| C. | 尿酸钠溶液呈酸性 | D. | 尿酸钠晶体一定难溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  实验室制取乙炔 | B. |  能证明非金属性Cl>C>Si | ||
| C. | 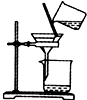 分离出Cl2与KI溶液反应生成的碘 | D. | 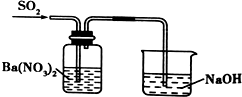 洗气瓶中产生白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
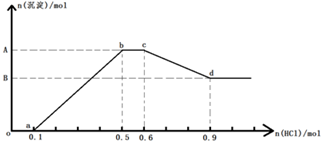
| A. | 原溶液中n(Na+)=0.6mol | B. | 原溶液中n(AlO2-)=0.3mol | ||
| C. | A点对应的沉淀物质的量为0.2mol | D. | bc段的反应为:CO32-+H+=HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 相关信息 | |
| A | 所处的周期数、族序数分别与其原子序数相等 |
| B | 原子核外电子有4种不同的运动状态 |
| C | 元素原子的核外成对电子数是未成对电子数的2倍且有3个能级 |
| D | 元素原子的核外p电子数比s电子数少1 |
| E | E原子的第一至第四电离能如下: I1=738kJ•mol-1 I2=1451kJ•mol-1 I3=7733kJ•mol-1 I4=10540kJ•mol-1 |
| F | 第四周期元素,其原子核外最外层电子数与A原子相同,其余各层电子均充满 |
 ,该同学所画的电子排布图违背了泡利原理.
,该同学所画的电子排布图违背了泡利原理.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com