
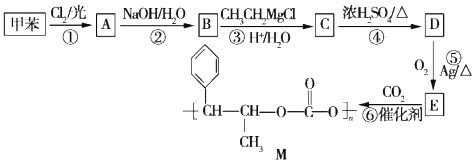
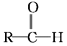 +R”ä-MgX”ś
+R”ä-MgX”ś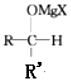 $\stackrel{H+/H_{2}O}{”ś}$
$\stackrel{H+/H_{2}O}{”ś}$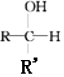 £ØR£¬R'¾łĪŖĢž»ł£©£»
£ØR£¬R'¾łĪŖĢž»ł£©£»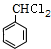 £¬D
£¬D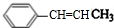 £¬E
£¬E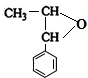 £®
£® £®BÓėŠĀÖʵÄCu£ØOH£©2Šü×ĒŅŗ¹²ČČ·“Ó¦
£®BÓėŠĀÖʵÄCu£ØOH£©2Šü×ĒŅŗ¹²ČČ·“Ó¦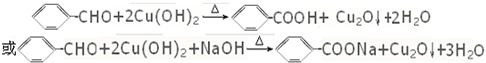 £®
£® £ØĢī½į¹¹¼ņŹ½£©£®
£ØĢī½į¹¹¼ņŹ½£©£® ·ÖĪö EµÄ·Ö×ÓŹ½ĪŖC9H10O£¬Ęä·Ö×ÓÖŠŗ¬ÓŠ1øöŗ¬ŃõČżŌŖ»·£¬ÓÉEÓė¶žŃõ»ÆĢ¼µÄ¾ŪŗĻ²śĪļ½į¹¹æÉÖŖ£¬EĪŖ £¬ÄęĶĘæÉÖŖDĪŖ
£¬ÄęĶĘæÉÖŖDĪŖ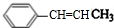 £¬ÓÉBÄÜ·¢ÉśŅų¾µ·“Ó¦¼°ŠÅĻ¢¢ņæÉÖŖ£¬¼×±½ÓėĀČĘų·¢Éś¶ųĀČČ”“śÉś³ÉAĪŖ
£¬ÓÉBÄÜ·¢ÉśŅų¾µ·“Ó¦¼°ŠÅĻ¢¢ņæÉÖŖ£¬¼×±½ÓėĀČĘų·¢Éś¶ųĀČČ”“śÉś³ÉAĪŖ £¬A·¢ÉśĖ®½ā·“Ӧɜ³ÉBĪŖ
£¬A·¢ÉśĖ®½ā·“Ӧɜ³ÉBĪŖ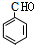 £¬BÓėCH3CH2MgCl·¢ÉśŠÅĻ¢ÖŠ¼Ó³É·“Ó¦£¬²¢Ė®½āÉś³ÉC£¬ŌņCĪŖ
£¬BÓėCH3CH2MgCl·¢ÉśŠÅĻ¢ÖŠ¼Ó³É·“Ó¦£¬²¢Ė®½āÉś³ÉC£¬ŌņCĪŖ £¬C·¢ÉśĻūČ„·“Ӧɜ³ÉD£¬ŅŌ“ĖĄ“½ā“š£®
£¬C·¢ÉśĻūČ„·“Ӧɜ³ÉD£¬ŅŌ“ĖĄ“½ā“š£®
½ā“š ½ā£ŗ£Ø1£©ÓÉÉĻŹö·ÖĪöæÉÖŖ£¬AĪŖ £¬DĪŖ
£¬DĪŖ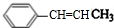 £¬EĪŖ
£¬EĪŖ £¬
£¬
¹Ź“š°øĪŖ£ŗ £»
£»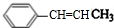 £»
£» £»
£»
£Ø2£©·“Ó¦¢ŁĪŖ¼×±½µÄČ”“ś·“Ó¦£¬·“Ó¦¢ŽŹĒ¶žŃõ»ÆĢ¼Óė µÄ¼Ó¾Ū·“Ó¦£¬
µÄ¼Ó¾Ū·“Ó¦£¬
¹Ź“š°øĪŖ£ŗČ”“ś·“Ó¦£»¼Ó¾Ū·“Ó¦£»
£Ø3£©·“Ó¦¢ÜµÄ»Æѧ·½³ĢŹ½ĪŖ £¬
£¬
BÓėŠĀÖʵÄCu£ØOH£©2Šü×ĒŅŗ¹²Čȵķ“Ó¦·½³ĢŹ½ĪŖ £¬
£¬
¹Ź“š°øĪŖ£ŗ £»
£» £»
£»
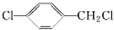
£Ø4£©AĪŖ £¬AµÄĶ¬·ÖŅģ¹¹ĢåÖŠŗ¬ÓŠ±½»·µÄæÉŅŌŹĒ±½»·ÉĻĮ¬ÓŠ-ClŗĶ-CH2Cl£¬ÕāŃłÓŠĮŚ¼ä¶ŌČżÖÖ½į¹¹£¬Ņ²æÉŅŌŹĒ±½»·Į¬ÓŠ-Cl”¢-Cl”¢-CH3£¬øł¾Ż¶Ø¶ž¶ÆŅ»µÄŌŌņ£¬ÕāŃłÓŠ6ÖÖ½į¹¹£¬ĖłŅŌ¹²ÓŠ9ÖÖ£¬ĘäÖŠŌŚŗĖ“Ź²ÕńĒāĘ×Ķ¼ÖŠ³öĻÖČż×é·å£¬ĒŅ·åĆ껿֮±ČĪŖ1£ŗ1£ŗ1µÄĪŖ
£¬AµÄĶ¬·ÖŅģ¹¹ĢåÖŠŗ¬ÓŠ±½»·µÄæÉŅŌŹĒ±½»·ÉĻĮ¬ÓŠ-ClŗĶ-CH2Cl£¬ÕāŃłÓŠĮŚ¼ä¶ŌČżÖÖ½į¹¹£¬Ņ²æÉŅŌŹĒ±½»·Į¬ÓŠ-Cl”¢-Cl”¢-CH3£¬øł¾Ż¶Ø¶ž¶ÆŅ»µÄŌŌņ£¬ÕāŃłÓŠ6ÖÖ½į¹¹£¬ĖłŅŌ¹²ÓŠ9ÖÖ£¬ĘäÖŠŌŚŗĖ“Ź²ÕńĒāĘ×Ķ¼ÖŠ³öĻÖČż×é·å£¬ĒŅ·åĆ껿֮±ČĪŖ1£ŗ1£ŗ1µÄĪŖ £¬
£¬
¹Ź“š°øĪŖ£ŗ9£» £®
£®
µćĘĄ ±¾Ģāæ¼²éÓŠ»śĪļµÄŗĻ³É£¬ĪŖøßĘµæ¼µć£¬°ŃĪÕ¹ŁÄÜĶŵıä»Æ”¢Ģ¼Į“±ä»Æ”¢ÓŠ»ś·“Ó¦ĪŖ½ā“šµÄ¹Ų¼ü£¬²ąÖŲ·ÖĪöÓėÓ¦ÓĆÄÜĮ¦µÄ漲飬עŅāÓŠ»śĪļŠŌÖŹµÄÓ¦ÓĆ£¬ĢāÄæÄѶČÖŠµČ£®


 ŌĶĮæģ³µĻµĮŠ“š°ø
ŌĶĮæģ³µĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Šü×ĒŅŗ | B£® | ±„ŗĶČÜŅŗ | ||
| C£® | ÖŹĮæ·ÖŹżŌ¼ĪŖ50%µÄČÜŅŗ | D£® | ĪļÖŹµÄĮæÅضČĪŖ10mol/LµÄČÜŅŗ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 1molFeI2Óė×ćĮæĀČĘų·“Ó¦Ź±×ŖŅʵĵē×ÓŹż2 NA | |
| B£® | ŌŚ1L 0.1mol/LµÄNa2CO3ČÜŅŗÖŠ£¬ŅõĄė×Ó×ÜŹżŠ”ÓŚ0.1NA | |
| C£® | 7.8g¹żŃõ»ÆÄĘÓĆÓŚŗōĪüĆę¾ßÖŠĶźČ«·“Ó¦Ź±×ŖŅʵē×Ó×ÜŹżĪŖ0.1 NA | |
| D£® | ½«1L 2mol/LµÄFeCl3ČÜŅŗ¼ÓČėµ½·ŠĖ®ÖŠ£¬¼ÓČČŹ¹Ö®ĶźČ«·“Ó¦£¬ĖłµĆĒāŃõ»ÆĢś½ŗĢåĮ£×ÓŹżĪŖ2NA |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Č¼ĆŗŹ±¹ÄČė¹żĮæµÄæÕĘųæÉŅŌ¼õÉŁĖįÓźµÄ²śÉś | |
| B£® | ĄūÓĆĘū³µĪ²Ęų“ß»Æ×°ÖĆæɽ«Ī²ĘųÖŠµÄNOŗĶCO×Ŗ»ÆĪŖĪŽŗ¦ĘųĢå | |
| C£® | ”°ĆŗøÄĘų”±”¢”°Ćŗøĵē”±µČ¹¤³ĢÓŠĄūÓŚ¼õÉŁĪķö² | |
| D£® | ¹¤Ņµ·ĻĘųÅÅ·ÅÖ®Ē°±ŲŠė»ŲŹÕ“¦ĄķŅŌ·ĄĪŪČ¾“óĘų |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā
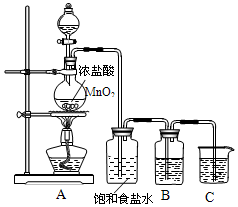 ŹµŃéŹŅÖĘČ”ĀČĘųµÄ×°ÖĆČēĶ¼£ŗ
ŹµŃéŹŅÖĘČ”ĀČĘųµÄ×°ÖĆČēĶ¼£ŗ²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 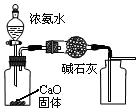 ÓĆĶ¼×°ÖĆÖĘČ”²¢ŹÕ¼ÆøÉŌļ“æ¾»µÄNH3 | |
| B£® |  ÓĆĶ¼×°ÖĆæÉŅŌĶź³É”°ÅēČŖ”±ŹµŃé | |
| C£® | 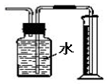 ÓĆĶ¼×°ÖĆÖ±½Ó²āĮæCuÓėÅØĻõĖį·“Ó¦²śÉśµÄNO2Ģå»ż | |
| D£® | 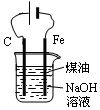 ÓĆĶ¼×°ÖĆÖʱøFe£ØOH£©2²¢ÄܽĻ³¤Ź±¼ä¹Ū²ģĘäŃÕÉ« |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ŅŃÖŖ£ŗH2£Øg£©+F2£Øg£©ØT2HF£Øg£©”÷H=-546.6 kJ•mol-1£¬Ōņ1 molĒāĘųÓė1 mol·śĘų·“Ӧɜ³É2mol ŅŗĢ¬·ś»ÆĒā·Å³öµÄČČĮæŠ”ÓŚ546.6 kJ | |
| B£® | 500”ę”¢30 MPaĻĀ£¬½«0.5 mol N2£Øg£©ŗĶ1.5 mol H2£Øg£© ÖĆÓŚĆܱÕČŻĘ÷ÖŠ³ä·Ö·“Ӧɜ³ÉNH3£Øg£©·ÅČČ19.3 kJ£®ĘäČČ»Æѧ·½³ĢŹ½ĪŖ£ŗN2£Øg£©+3H2£Øg£©?2NH3£Øg£©”÷H=-38.6 kJ•mol-1 | |
| C£® | H+£Øaq£©+OH-£Øaq£©ØTH2O£Øl£©”÷H=-57.3 kJ•mol-1£¬ŌņH2SO4£Øaq£©+Ca£ØOH£©2£Øaq£©ØTCaSO4£Øs£©+2H2O£Øl£©”÷H=2”Į£Ø-57.3£©kJ•mol-1 | |
| D£® | ŌŚ101 kPaŹ±£¬2 g H2ĶźČ«Č¼ÉÕÉś³ÉŅŗĢ¬Ė®£¬·Å³ö285.8 kJČČĮ棬ĒāĘųČ¼ÉÕµÄČČ»Æѧ·½³ĢŹ½±ķŹ¾ĪŖ2H2£Øg£©+O2£Øg£©ØT2H2O£Øl£©”÷H=-571.6 kJ•mol-1 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 5ÖÖ | B£® | 8ÖÖ | C£® | 6ÖÖ | D£® | 7ÖÖ |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com