
【题目】某工厂的废液经测定其主要含有乙醇,此外还有丙酮、乙酸和乙酸乙酯.以上各物质的沸点如下:
物质 | 丙酮 | 乙酸乙酯 | 乙醇 | 乙酸 |
沸点/℃ | 56.2 | 77.06 | 78 | 117.9 |
现拟通过下列步骤回收乙醇和乙酸:
①向废液中加入甲溶液;②将混合液放入蒸馏器中缓缓加热;③收集温度在70℃~85℃之间的馏出物;④排出蒸馏器中的残液,冷却后向其中加入乙溶液(过量),然后再放入蒸馏器中进行蒸馏,收集馏出物.
可选用试剂:A.烧碱溶液 B.浓硫酸 C.饱和食盐水 D.浓盐酸
请回答下列问题:
(1)乙醇的沸点比丙酮沸点高的主要原因是 .
(2)加入甲溶液是 , (填A B C D序号),涉及到的反应方程式: .
(3)在70℃~85℃时馏出物的主要成分为 .
(4)在步骤④中加入过量的乙溶液是 . (填A B C D序号),
(5)最后蒸馏的温度控制在 .
(6)在蒸馏操作中,仪器选择及安装都正确的是:(填标号)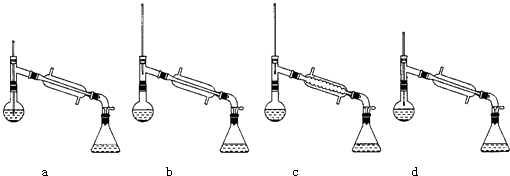
如果蒸馏前忘记加沸石,液体温度已接近沸点时,应该如何处理? .
【答案】
(1)乙醇分子之间易形成氢键
(2)A;CH3COOCH2CH3+NaOH→CH3COONa+CH3CH2OH、CH3COOH+NaOH→CH3COONa+H2O
(3)乙醇
(4)B
(5)117.9℃左右
(6)b;移开热源,待温度降低,再投入沸石,重新加热
【解析】解:(l)醇类分子间能形成氢键,会导致沸点升高,而丙酮分子之间不易形成氢键,氢键大大增加了分子间作用力,所以乙醇的沸点比丙酮沸点高,所以答案是:乙醇分子之间易形成氢键;(2)根据表中数据可知,需要先收集乙醇,然后收集乙酸,且乙酸易挥发,所以应该先加入A烧碱溶液,发生反应为:CH3COOCH2CH3+NaOH→CH3COONa+CH3CH2OH、CH3COOH+NaOH→CH3COONa+H2O,从而将乙酸乙酯、乙酸转化成乙酸钠、乙醇,所以答案是:A;CH3COOCH2CH3+NaOH→CH3COONa+CH3CH2OH、CH3COOH+NaOH→CH3COONa+H2O;(3)根据乙醇、丙酮、乙酸和乙酸乙酯的沸点可知,在70℃~85℃时馏出物的主要成分为乙醇,所以答案是:乙醇; (4)加入试剂B的目的是将乙酸钠转化成乙酸,选用的应该为强酸,由于浓盐酸具有挥发性,应该用浓硫酸,所以选B,所以答案是:B;(5)最后回收的是乙酸,乙酸的沸点为117.9℃,所以应该将温度控制在117.9℃左右,所以答案是:117.9℃左右;(6)在蒸馏操作中,温度计的水银球要放在蒸馏烧瓶的支管口处,所以ad错误;c中使用的是球形冷凝管容易使产品滞留,不能全部收集到锥形瓶中,因此仪器及装置安装正确的是b;如果蒸馏前忘记加沸石,液体温度已接近沸点时,正确的操作方法为:移开热源,待温度降低,再投入沸石,重新加热,所以答案是:b;移开热源,待温度降低,再投入沸石,重新加热.


科目:高中化学 来源: 题型:
【题目】由短周期元素组成的中学常见无机物A、B、C、D、E、X存在如下图转化关系(部分生成物和反应条件略去)。下列推断不正确的是

A. 若A 是单质,B和D 的反应是OH-+HCO3-=H2O+ CO32-,则E一定能还原Fe2O3
B. 若D为CO,C能和E反应,则A一定为Na2O2
C. 若X是Na2CO3,C为CO2,则A一定是氯气,且D和E不反应
D. 若D为白色沉淀,与A摩尔质量相等,则X一定是铝盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的发生与沉淀溶解平衡或盐类水解平衡的移动无关的是
A. 盐酸与碳酸钙反应生成二氧化碳
B. 镁条与氯化铵溶液反应生成氢气
C. 硝酸银溶液与盐酸反应生成氯化银
D. 硫酸铝溶液和小苏打溶液反应生成二氧化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅蓄电池是常见的二次电池,电池总反应为:Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O,下列说法正确的是
2PbSO4+2H2O,下列说法正确的是
A. 放电时PbO2发生氧化反应
B. 放电时的负极反应式为Pb+SO42--2e-=PbSO4
C. 充电时电解质溶液的质量减少
D. 充电时的阴极反应式为PbSO4+2H2O-2e-==PbO2+SO42-+4H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将等体积,等物质的量浓度的NH4HCO3与NaCl溶液混合,析出部分NaHCO3晶体,过滤,所得滤液pH<7.下列关于滤液中的离子浓度关系不正确的是( )
A.![]() <1.0×10﹣7mol/L
<1.0×10﹣7mol/L
B.c(Na+)=c(HCO ![]() )+c(CO
)+c(CO ![]() )+c(H2CO3)
)+c(H2CO3)
C.c(H+)+c(NH4+)>c(OH﹣)+c(HCO ![]() )+2 c(CO
)+2 c(CO ![]() )
)
D.c(Cl﹣)>c(HCO ![]() )>c(NH4+)>c(CO
)>c(NH4+)>c(CO ![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子能共存的是:
A.K+、Cl-、HCO3-、H+B.NH4+、Cl-、OH-、SO42-
C.Na+、Cl-、Fe3+、NO3-D.Ba2+、Cl-、Al3+、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1 mol某气态烃能与1 mol氯化氢发生加成反应,加成后的产物又可与7 mol氯气发生完全的取代反应,则该烃的结构简式为
A. CH2=CH2 B. CH3CH=CH2 C. .CH3CH2CH=CH2 D. CH3CH2CH2CH=CH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:相关物质的溶度积常数见表:
物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
Ksp | 2.2×10﹣20 | 2.6×10﹣39 | 1.7×10﹣7 | 1.3×10﹣12 |
现有某酸性CuCl2溶液中含有少量的FeCl2 , 为得到纯净的CuCl22H2O晶体,按如图步骤进行提纯:
(1)最适合作氧化剂X的是(填字母),加入X的目的是 . A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
加入的物质Y是(填化学式),调至溶液pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)= . 过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl22H2O晶体.
(2)某学习小组用“间接碘量法”测定含有CuCl22H2O晶体的试样(不含能与I﹣发生反应的氧化性杂质)的纯度,过程如下:取0.36g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀.用0.1000molL﹣1Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00mL.(I2+2S2O32﹣═S4O62﹣+2I﹣)①可选用作滴定指示剂.②CuCl2溶液与KI反应的离子方程式为 .
③该试样中CuCl22H2O的质量百分数为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com