
【题目】已知:①Na2SO3+2H2O+I2=Na2SO4+2HI; ②Cl2+2Fe2+=2Fe3++2Cl-;③I2+Fe2+不反应,向含SO32-、Fe2+、I-各0.1 mol的溶液中通入标准状况下的Cl2,通入Cl2的体积和溶液中相关离子的物质的量的关系图正确的是
A.  B.
B.  C.
C.  D.
D. 
【答案】C
【解析】
离子还原性SO32-> I->Fe2+、故首先发生反应①SO32-+H2O+Cl2=SO42-+2Cl-+2H+,再发生反应2I-+ Cl2=I2+ 2Cl-,然后发生反应2Fe2++Cl2= 2Fe3++2Cl- ,根据发生反应顺序计算离子开始反应到该离子反应完毕时氯气的体积,
A.由SO32-+H2O+Cl2=SO42-+2Cl-+2H+,可以知道,0.1molSO32-完全反应需要消耗0.1mol氯气,标准状况下的Cl2的体积为: 0.1mol![]() 22.4L/mol=2.24L,图象中氯气的体积与计算结果不一致,故A错误;B. 0.1molSO32-完全反应后,然后发生2I-+ Cl2=I2+ 2Cl-,0.1molSO32-完全反应需要消耗0.1mol 氯气,故开始反应时氯气的体积为2.24L , 0.1molI- 完全反应消耗0.05氯气,故0.1molI-完全反应时氯气的体积为:0.15mol
22.4L/mol=2.24L,图象中氯气的体积与计算结果不一致,故A错误;B. 0.1molSO32-完全反应后,然后发生2I-+ Cl2=I2+ 2Cl-,0.1molSO32-完全反应需要消耗0.1mol 氯气,故开始反应时氯气的体积为2.24L , 0.1molI- 完全反应消耗0.05氯气,故0.1molI-完全反应时氯气的体积为:0.15mol![]() 22.4L/mol=3.36L ,图象中氯气的体积与计算结果不一致,故B错误;C.0.1molSO32-完全反应需要消耗0.1mol 氯气, 0.1molI-完全反应消耗0.05氯气,故亚铁离子开始反应时氯气的体积为: 0.15mol
22.4L/mol=3.36L ,图象中氯气的体积与计算结果不一致,故B错误;C.0.1molSO32-完全反应需要消耗0.1mol 氯气, 0.1molI-完全反应消耗0.05氯气,故亚铁离子开始反应时氯气的体积为: 0.15mol![]() 22.4L/mol=3.36L ,由2Fe2++Cl2=2Fe3++2Cl- 可以知道, 0.1mol Fe2+ 完全反应消耗0.05氯气,故Fe2+完全时消耗的氯气体积为: 0.20mol
22.4L/mol=3.36L ,由2Fe2++Cl2=2Fe3++2Cl- 可以知道, 0.1mol Fe2+ 完全反应消耗0.05氯气,故Fe2+完全时消耗的氯气体积为: 0.20mol![]() 22.4L/mol=4.48L ,图象与实际一致,故C选项是正确的;D.SO32-、Fe2+、I-完全时消耗的氯气为0.20mol,产生的氯离子为0.40 mol和,图象中氯离子的物质的量不符,故D错误;答案:C
22.4L/mol=4.48L ,图象与实际一致,故C选项是正确的;D.SO32-、Fe2+、I-完全时消耗的氯气为0.20mol,产生的氯离子为0.40 mol和,图象中氯离子的物质的量不符,故D错误;答案:C


 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源: 题型:
【题目】用漂白粉溶液浸泡过的有色布条,如果晾置在空气中,过了一段时间,其漂白效果会更好的原因可能是
A. 漂白粉被空气中的氧气氧化了 B. 漂白粉在空气中生成了较多量的 HClO
C. 有色布条被空气中的氧气氧化了 D. 漂白粉溶液蒸发掉部分水,其浓度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为确定碳酸钠和碳酸氢钠混合样品中碳酸钠的质量分数,可通过加热分解得到的 CO2 质量进行 计算,某同学设计的实验装置示意图如下:
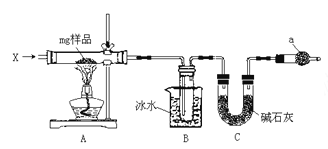
请回答:
(1)仪器 C 的名称是__________;
(2)装置 B 中冰水的作用是__________;
(3)该同学设计的实验装置存在缺陷,有关该实验装置及实验 过程中,下列因素可能使碳酸钠的质量分数偏高的是__________。
A.样品分解不完全
B.装置 B、C 之间缺少 CO2 的干燥装置
C.产生 CO2 气体的速率太快,没有被碱石灰完全吸收
D.反应完全后停止加热,通入过量的空气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①C6H12O6(s)===2C2H5OH(l)+2CO2(g) ΔH1
② 6CO2(g)+6H2O(g)===C6H12O6(s)+6O2(g) ΔH2
③ 2H2O(g) ===2H2(g)+O2(g) ΔH3
④ 2CO2(g)+6H2(g) === C2H5OH(l)+3H2O(g) ΔH4
下列有关说法正确的是( )
A. H2的燃烧热为![]()
B. 反应①使用催化剂,ΔH1将减小
C. 标准状况下,反应②生成1.12 L O2,转移的电子数为0.1×6.02×1023
D. 2ΔH4=ΔH1+ΔH2-6ΔH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】11.2g Fe加入一定量的HNO3充分反应后,生成Fe2+、Fe3+的物质的量之比为1:4,将生成的气体NXOY与一定量的O2混合后通入水中,反应后无气体剩余(NXOY+O2+H2O-HNO3 ),则通入的氧气的物质的量是
A. 0.12mol B. 0.14mol C. 0.2mol D. 0.13mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 向稀醋酸溶液中加入少量醋酸钠固体,醋酸的电离程度增大
B. 电镀时,通常把待镀金属制品作阴极,镀层金属作阳极
C. 常温下,2NO2(g)=2NO(g)+O2(g)不能自发进行,则该反应的△H>0
D. 工业通过反应“Na(l)+KCl(l) ![]() NaCl(l)+K(g)”冶炼钾,说明钠的金属性强于钾
NaCl(l)+K(g)”冶炼钾,说明钠的金属性强于钾
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸铈铵、磷酸锰铵是两种重要的复盐,在工农业生产中具有广泛应用。
(1) 复盐是由两种或两种以上金属离子(或铵根离子)和一种酸根离子构成的盐。下列物质属于复盐的是________(填序号)。
A.BaFe2O4 B.NaHSO4 C.KAl(SO4)2·12H2O D.Ag (NH3)2OH
(2) 硝酸铈铵[(NH4)2Ce(NO3)6]的制备方法如下:

①“氧化”得到CeO2的化学方程式为________________________________。
②证明CeO2已经洗涤干净的方法是_____________________________。
(3) 为测定磷酸锰铵[(NH4)aMnb(PO4)c·xH2O]的组成,进行如下实验:①称取样品2.448 0 g,加水溶解后配成100.00 mL溶液A;②量取25.00 mL溶液A,加足量NaOH溶液并充分加热,生成NH3 0.067 20 L(标准状况);③另取25.00 mL溶液A,边鼓空气边缓慢滴加氨水,控制溶液pH 6 ~ 8,充分反应后,将溶液中Mn2+转化为Mn3O4,得Mn3O4 0.2290 g。通过计算确定该样品的化学式(写出计算过程) __________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解饱和食盐水可以产生氯气、氢气和氢氧化钠,氯气与石灰乳反应可制漂白粉:2Cl2 +2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O。
(1)请写出电解饱和食盐水的化学方程式,若为氧化还原反应则用单线桥标出电子转移的方向和数目_______________。
(2)若电解饱和食盐水时消耗NaCl 58.5g,试计算理论上最多可得到氯气的体积(标准状况)为多少__________?
(3)若将1mol氯气通入石灰乳中,理论上可得到Ca(ClO)2的质量是多少_______?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com