
【题目】KClO3是一种常见的氧化剂,常用于医药工业、印染工业和制造烟火。实验室用KClO3和MnO2混合加热制氧气,现取KClO3和MnO2的混合物16.60g加热至恒重,将反应后的固体加15g水充分溶解,剩余固体6.55g(25℃),再加5g水充分溶解,仍剩余固体4.80g(25℃)。
(1)若剩余的4.80g固体全是MnO2,则原混合物中KClO3的质量为___g;
(2)若剩余的4.80g固体是MnO2和KCl的混合物
①求25℃时KCl的溶解度___;
②求原混合物中KClO3的质量___;
③所得KCl溶液的密度为1.72g/cm3,则溶液的物质的量浓度为多少___?(保留2位小数)
(3)工业常利用3Cl2+6KOH(热)→KClO3+5KCl+3H2O,制取KClO3(混有KClO)。实验室模拟KClO3制备,在热的KOH溶液中通入一定量氯气充分反应后,测定溶液中n(K+):n(Cl-)=14:11,将所得溶液低温蒸干,那么在得到的固体中KClO3的质量分数的取值范围为多少?___
【答案】11.80 35g 12.25g 5.99mol/L 0.212~0.238
【解析】
(1)根据2KClO3![]() 2KCl+3O2
2KCl+3O2![]() 反应原理,MnO2不溶于水,KCl溶于水进行分析计算;
反应原理,MnO2不溶于水,KCl溶于水进行分析计算;
(2)若剩余的4.80g固体是MnO2和KCl的混合物,则5g水溶解氯化钾得到的溶液是饱和溶液,据此计算其溶解度;反应前后质量减少的质量为氧气的质量,根据氯酸钾和氧气之间的关系式计算氯酸钾的质量;根据溶液质量、密度计算溶液体积,再结合c=![]() 计算溶液的物质的量浓度;
计算溶液的物质的量浓度;
(3)测定溶液中n(K+):n(Cl-)=14:11结合氯气与KOH反应生成氯酸钾和KCl或KClO和KCl来计算质量分数的范围。
(1)若剩余的4.80g固体全是MnO2,m(KClO3)=16.60g-4.80g=11.80g,故答案为:11.80;
(2)若剩余的4.80g固体是MnO2和KCl的混合物,则5g水溶解氯化钾得到的溶液是饱和溶液,5g水溶解KCl的质量=6.55g-4.80g=1.75g,
①则100g水溶解KCl的质量=![]() ,25°C时KCl的溶解度35g;故答案:35g;
,25°C时KCl的溶解度35g;故答案:35g;
②20g水溶解氯化钾的质量=1.75g![]() 4=7g,反应前后质量减少的质量为氧气的质量,氧气的质量=16.60g-7g-4.80g=4.8g,根据氧原子守恒得
4=7g,反应前后质量减少的质量为氧气的质量,氧气的质量=16.60g-7g-4.80g=4.8g,根据氧原子守恒得 =12.25g,所以原混合物中KClO3的质量12.25g,故答案为:12.25g;
=12.25g,所以原混合物中KClO3的质量12.25g,故答案为:12.25g;
③溶液的质量=20g+7g=27g,溶液的体积=![]() ,n(KCI)=
,n(KCI)=![]() ,则溶液的物质的量浓度=
,则溶液的物质的量浓度= =5.99mol/L,所以答案为:5.99mol/L;
=5.99mol/L,所以答案为:5.99mol/L;
(3)测定溶液中n(K+):n(Cl-)=14:11,设钾离子为14mol,氯离子11mol;
①由零价氯变成负一价的氯,一共需要得到11mol电子,如果剩下的K离子是氯酸钾和次氯酸钾,由得失电子守恒可知氯酸钾是2mol,次氯酸钾是1mol,所以得到的晶体是11molKCl,1molKClO,2molKClO3氯酸钾的质量分数=![]() =0.212
=0.212
②由零价氯变成负一价的氯一共需要得到11mol电子,若其余为氯酸钾和氢氧化钾的混合物,由得失电子守恒可以得到氯酸钾的质量分数=![]() =0.238,所以得到的固体中KClO3的质量分数的取值范围为0.212~0.238,故答案:0.212~0.238。
=0.238,所以得到的固体中KClO3的质量分数的取值范围为0.212~0.238,故答案:0.212~0.238。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】如图是某有机物分子中C、H、O、N四种原子的成键方式示意图(短线表示单键或者双键)。下列关于该有机物的说法正确的是
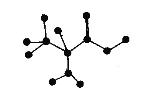
A.在一定条件下,可以通过聚合反应生成高分子化合物
B.分子式为C3H6NO2
C.能和NaOH溶液反应,但不能和盐酸溶液反应
D.不能和NaHCO3溶液反应生成CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一个石墨作电极,电解稀的Na2SO4溶液的装置,通电后在石墨电极A和B附近分别滴加一滴石蕊溶液。下列有关叙述正确的是
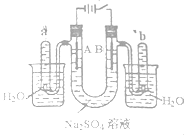
A.逸出气体的体积,A电极的小于B电极的
B.一电极逸出无味气体,另一电极逸出刺激性气味气体
C.A电极附近呈红色,B电极附近呈蓝色
D.电解一段时间后,将全部电解液转移到同一烧杯中,充分搅拌后溶解呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关键环节考核:
(1)将AgNO2和AgCl的饱和溶液等体积混合后,加入足量的硝酸银溶液,生成的沉淀n(AgNO2)________n(AgCl)(填“大于”、“小于”或“等于”)。(已知该温度下,Ksp(AgNO2)=2×10-8;Ksp(AgCl)=1.8×10-10)
(2)CaSO3溶液与CaCl2溶液混合会生成难溶的CaSO3(Ksp=3.1×10-7),现将等体积的CaCl2溶液与Na2SO3溶液混合,若混合前Na2SO3溶液浓度为2×10-3 mol·L-1,则生成沉淀所需CaCl2溶液的最小浓度为__________________。
学法题:通过上题第(2)问的计算,请思考利用溶度积常数(Ksp)进行定量计算,代入离子浓度时需要注意的关键是什么?__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的产物中,有的有同分异构体,有的没有同分异构体,其中一定不存在同分异构体的反应是( )
A. 异戊二烯(![]() )与等物质的量的Br2发生加成反应
)与等物质的量的Br2发生加成反应
B. 2-氯丁烷与乙醇溶液共热发生消去分子的反应
C. 甲苯在一定条件下发生硝化反应生成一硝基甲苯的反应
D. 邻羟基苯甲酸与NaHCO3溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】葡萄酒中抗氧化剂的残留量是以游离SO2的含量计算,我国国家标准(GB2760-2014)规定葡萄酒中SO2的残留量≤0.25g/L。某兴趣小组设计实验方案对葡萄酒中SO2进行测定。
Ⅰ.定性实验方案如下:
(1)将SO2通入水中形成SO2 ─饱和H2SO3溶液体系,此体系中存在多个含硫元素的平衡,分别用平衡方程式表示为_______________。
(2)利用SO2的漂白性检测干白葡萄酒(液体为无色)中的SO2或H2SO3。设计如下实验:

实验结论:干白葡萄酒不能使品红溶液褪色,原因为:_________________________。
Ⅱ.定量实验方案如下(部分装置和操作略):
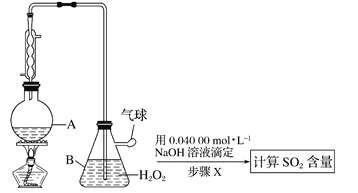
(3)仪器A的名称是________________。
(4)A中加入100.0mL葡萄酒和适量盐酸,加热使SO2全部逸出并与B中H2O2完全反应,其化学方程式为______________。
(5)除去B中过量的H2O2,然后再用NaOH标准溶液进行滴定, 除去H2O2的方法是__________。
(6)步骤X滴定至终点时,消耗NaOH溶液25.00mL,该葡萄酒中SO2的含量为__________g/L。该测定结果比实际值偏高,分析原因________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知蓄电池在充电时作电解池,放电时作原电池.如图是铅蓄电池的工作示意图,其反应原理为:PbO2+Pb+2H2SO4![]() 2PbSO4+2H2O下列说法中错误的是( )
2PbSO4+2H2O下列说法中错误的是( )

A.b电极放电后转化为c电极
B.电极a和d都发生还原反应
C.b的电极反应式:Pb+SO42﹣﹣2e-→PbSO4
D.放电后硫酸溶液的pH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是
A.向0.1 mol·L-1 CH3COOH溶液中加入少量水,溶液中![]() 减小
减小
B.将CH3COONa溶液从20℃升温至30℃,溶液中![]() 增大
增大
C.向盐酸中加入氨水至中性,溶液中![]() >1
>1
D.向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中![]() 不变
不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高炉炼铁过程中发生反应:![]() ,该反应在不同温度下的平衡常数见表。下列说法正确的是( )
,该反应在不同温度下的平衡常数见表。下列说法正确的是( )
温度T/℃ | 1000 | 1150 | 1300 |
平衡常数K | 4.0 | 3.7 | 3.5 |
A.平衡后温度不变缩小容器容积,![]() 的转化率升高
的转化率升高
B.增加高炉的高度可以有效降低炼铁尾气中CO的含量
C.其他条件不变时,增大c(CO),该反应的K值增大
D.由表中数据可判断该反应:反应物总能量大于生成物的总能量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com