

| A.a点的溶液呈中性 |
| B.b点到c点之间发生反应的离子方程式是:Al3++2SO42-+2Ba2++3OH— =Al(OH)3↓+2BaSO4↓ |
| C.c点加入Ba(OH)2溶液的体积为200 mL |
| D.c点溶液呈碱性 |
科目:高中化学 来源:不详 题型:单选题
| A.向滴有酚酞的硅酸钠溶液中边加边振荡地滴加盐酸至红色变浅并接近消失 2H++SiO32—=H2SiO3(胶体) |
B.用惰性电极电解MgCl2溶液:2Cl—+2H2O Cl2↑+H2↑+2OH— Cl2↑+H2↑+2OH— |
C.碳酸氢铵溶液与足量的NaOH溶液混合后加热: NH4++OH- NH3↑+H2O NH3↑+H2O |
| D.5.6 g Fe与200 mL 2.0 mol/L HNO3溶液充分反应:3Fe + 2NO3—+ 8H+=3Fe2+ + 2NO↑ + 4H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
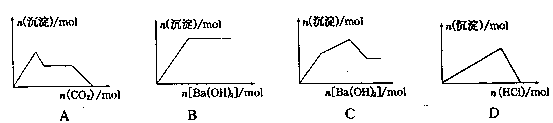
| A.向含0.01mol KOH和0.01mol Ca(OH)2的混合溶液中缓慢通入CO2至过量 |
| B.向NaHSO4溶液中逐滴加入Ba(OH)2溶液至过量 |
| C.向KAl(SO4)2溶液中逐滴加入Ba(OH)2溶液至过量 |
| D.向NaAlO2溶液中逐滴加入盐酸至过量 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.O~A段反应的化学方程式是Ba(OH)2+CO2=BaCO3↓+H2O |
| B.B~C段反应的离子方程式是2AlO2-+3H2O+CO2=2Al(OH)3↓+CO32- |
| C.A~B段与C~D段所发生的反应相同 |
| D.D~E段沉淀的减少是由于碳酸钡固体的消失所致 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.实验室用大理石跟稀盐酸制取二氧化碳:2H++CO32﹣=CO2↑+H2O |
| B.将铝粉投入氢氧化钠溶液中:2Al+2OH﹣=2AlO2﹣+H2↑ |
| C.向Ca(ClO)2溶液中通过量CO2气体:Ca2++2ClO﹣+CO2+H2O=CaCO3↓+2HClO |
| D.硅酸钠溶液与醋酸溶液混合:SiO32﹣+2HAc=H2SiO3↓+2Ac﹣ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①③ | B.①④⑤ | C.②④⑤ | D.①⑤ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.向次氯酸钙溶液通入过量CO2: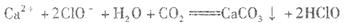 |
B.向次氯酸钙溶液通入SO2: |
C.氢氧化钙溶液与碳酸氢镁溶液反应: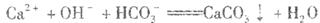 |
D.氯化亚铁溶液中加入稀硝酸: |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 N2(g)+2CO2(g);△H<0。
N2(g)+2CO2(g);△H<0。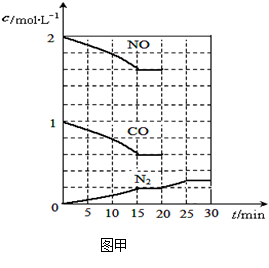
| A.加入催化剂 | B.降低温度 | C.缩小容器体积 | D.增加CO2的量 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1.0 mol·L-1的CaCl2溶液:Na+、K+、Cl-、CO32- |
| B.1.0 mol·L-1的HNO3溶液:K+、[Ag(NH3)2]+、Cl-、SO42- |
| C.1.0 mol·L-1的KI溶液:Na+、Fe3+、Cl-、SO42- |
| D.澄清透明的溶液:Cu2+、SO42-、Mg2+、Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com