
【题目】如图是镁元素和硫元素的相关信息,由此不能得到的信息是( )

A.镁属于金属元素
B.镁原子核内有12个质子
C.镁离子与硫离子的电子层数相等
D.在化学反应中,1个硫原子容易得到2个电子
科目:高中化学 来源: 题型:
【题目】四氯化锡可用作媒染剂,有机合成中氯化的催化剂等。某学习小组设计了如图所示的装置(夹持和加热仪器省略)制备无水四氯化锡。反应原理是Sn+2Cl2=SnCl4。
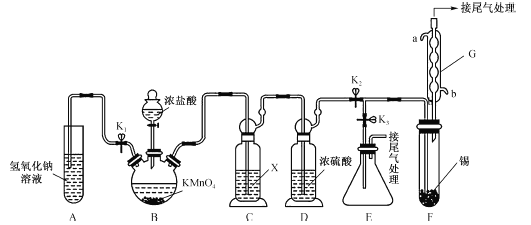
已知:
化学式 | SnCl2 | SnCl4 |
熔点/℃ | 247 | -33 |
沸点/℃ | 623 | 114 |
其他性质 | 无色晶体,易被氧化 | 无色液体,易水解 |
请回答下列问题:
(1)装置G的名称为__________,该装置的进水口为__________(填“a”或“b”)。
(2)装置B中发生反应的离子方程式为__________。
(3)装置C的作用是除去氯化氢,所用试剂X的名称是_________。
(4)按图连接好装置,检查装置气密性,关闭K1、K3,打开K2,慢慢滴入浓盐酸,待观察到装置F内充满黄绿色气体后,开始加热装置F,当装置F中的固体完全消失,充满SnCl4气体时,将生成的SnCl4排入接收器E中的操作是:停止加热装置F,关闭分液漏斗活塞,__________,再用洗耳球从G的上出口向装置内吹气。
(5)某同学认为装置F中的反应可能产生SnCl2杂质。下列试剂中,可用于检测反应是否产生了SnCl2的有__________(填字母)。
a.FeCl3溶液(滴有KSCN) b.H2O2溶液 c.溴水 d.AgNO3溶液
(6)SnCl4能溶解一定量的氯气,若制取3 kg SnCl4(含氯气的质量分数为13.0%,假设不含除氯气外的其他杂质),则至少需通入氯气的体积(标准状况下)是__________m3(保留两位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含氯的盐NaClO2是一种重要的含氯消毒剂。以下是过氧化氢法生产NaClO2的工艺流程图:
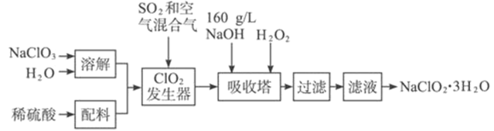
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2·3H2O。
②ClO2的沸点为283 K,纯ClO2易分解爆炸,常用稀有气体或空气稀释防止爆炸性分解
(1)NaClO2 的名称为_______________
(2)ClO2发生器中所发生反应的化学方程式为_______________,发生器中鼓入空气的作用可能是_______________(选填序号)。
a.将SO2氧化成SO3,增强酸性; b.稀释ClO2以防止爆炸; c.将NaClO3氧化成ClO2
(3)吸收过程中所用还原剂的还原性应适中,原因是_________,除H2O2外,还可以选择的还原剂是____________(填序号)
A.Na2O2 B.Na2S C.FeCl2 D.KMnO4
(4)从滤液中得到NaClO2·3H2O粗晶体的实验操作依次是____________(选填序号)。
A.蒸馏 B.蒸发 C.灼烧 D.过滤 E.冷却结晶
(5)将所得的NaClO2·3H2O晶体用冰水洗涤烘干,如何确定该晶体洗涤干净?
________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大气中氮氧化物和碳氢化合物受紫外线作用可产生二次污染物光化学烟雾,其中某些反应过程如图所示。下列说法不正确的是( )
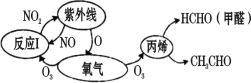
A. NO2不是酸性氧化物B. O2和O3是氧的两种同素异形体
C. 反应I属于氧化还原反应D. 烟雾是一种固溶胶,其分散剂是空气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、氮、硫的化合物在生产生活中广泛存在。请回答:
(1)以CO2与NH3为原料可合成化肥尿素[CO(NH2)2]。已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s) ΔH=-l59.5kJ·mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(l) ΔH=-160.5kJ·mol-1
写出CO2与NH3合成尿素和液态水的热化学反应方程式__。
(2)T温度时在容积为2L的恒容密闭容器中只充入1.00molNO2气体发生反应:2NO(g)+O2(g)![]() 2NO2(g) H<0。不同时刻测得容器中n(NO2)如下表:
2NO2(g) H<0。不同时刻测得容器中n(NO2)如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO2)/mol | 1.00 | 0.80 | 0.65 | 0.55 | 0.50 | 0.50 |
①升高温度K值___(增大、减小),T温度时化学平衡常数K=___mol-1·L
②从0~2s该反应的平均速率v(NO2)=___。
③对可逆反应2NO(g)+O2(g)![]() 2NO2(g) H<0。恒温,恒容密闭容器中,下列说法中,能说明该反应达到化学平衡状态的是___。
2NO2(g) H<0。恒温,恒容密闭容器中,下列说法中,能说明该反应达到化学平衡状态的是___。
A.混合气体的密度不再变化
B.混合气体的压强不再变化
C.氧气的转化率不再变化
D.N2、O2、NO的物质的量之比为1:1:2
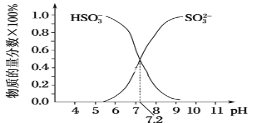
(3)常温下,用SO2与NaOH溶液反应可得到NaHSO3、Na2SO3等。
①已知Na2SO3水溶液显碱性,原因是___(写出主要反应的离子方程式),该溶液中,c(Na+)___2c(SO32-)+c(HSO3-)(填“>”“<”或“=”)。
②在某NaHSO3、Na2SO3混合溶液中HSO3-、SO32-物质的量分数随pH变化曲线如图所示(部分),根据图示,则SO32-的第一步水解平衡常数=____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次递增,a、b、c、d、e、f是由这些元素组成的化合物,d是淡黄色粉末,m为元素Y的单质,通常为无色无味的气味。上述物质的转化关系如图所示。下列说法错误的是
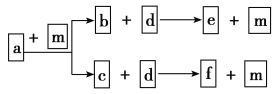
A.简单离子半径:Z<YB.阴离子的还原性:Y>W
C.简单气态氢化物的热稳定性:Y>XD.W、Y、Z形成的化合物含有共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国是最早发现并使用青铜器的国家。司母戊鼎是迄今为止出土的世界上最大、最重的青铜礼器,享有“镇国之宝”的美誉(如图1)。
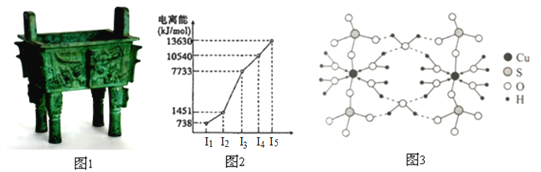
(1)Cu原子的外围电子排布式为_______。
(2)图2所示为第四周期某主族元素的第一至五电离能数据,该元素是_______,I3远大于I2的原因是_______。
(3)图3是某含铜配合物的晶体结构示意图。
①晶体中H2O和SO42-的中心原子的杂化类型为_______,试判断H2O和SO42-的键角大小关系并说明原因_______。
②图3中的氢键有(H2O)O—H···O(H2O)和_______。
③写出该配合物的化学式_______。
(4)一种铜的氯化物晶胞结构如下图所示。
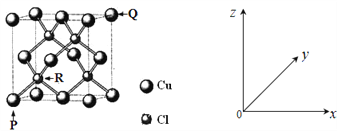
该化合物的化学式为_______,已知P、Q、R的原子坐标分别(0,0,0)、(1,1,1)、 (![]() ,
,![]() ,
,![]() ),若Cu原子与最近的Cl原子的核间距为a pm,则该晶体的密度计算表达式为_______。
),若Cu原子与最近的Cl原子的核间距为a pm,则该晶体的密度计算表达式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)微型纽扣电池在现代生活中有广泛应用。有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH溶液,电极反应为Zn+2OH--2e-===ZnO+H2O,Ag2O+H2O+2e-===2Ag+2OH-。根据上述反应式,完成下列题目。

(a)下列叙述正确的是________。
A.在使用过程中,电解质溶液的pH增大
B.使用过程中,电子由Ag2O极经外电路流向Zn极
C.Zn是负极,Ag2O是正极
D.Zn电极发生还原反应,Ag2O电极发生氧化反应
(b)写出电池的总反应式:___________________。
(2)某研究性学习小组将下列装置如图连接,C、D、E、F、X、Y都是惰性电极。将电源接通后,向乙中滴入酚酞试液,在F极附近显红色。试回答下列问题:
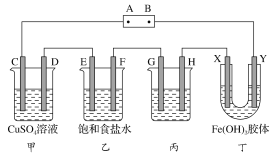
(a)电源A极的名称是________。
(b)甲装置中电解反应的总化学方程式:___________
(c)如果收集乙装置中产生的气体,两种气体的体积比是________。
(d)欲用丙装置给铜镀银,G应该是________(填“铜”或“银”)。
(e)装置丁中的现象是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.实验室常用如图中的装置制备乙炔并检验乙炔的性质:
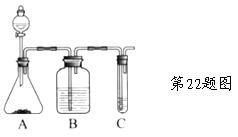
(1)实验室制备乙炔的化学方程式是_______________________________;
(2)实验过程中,为减缓生成乙炔的速率,通常采取的措施是:___________________________________________________________;
(3)B中试剂是 ;
(4)若C中试剂是溴水,可以观察到的现象是_________________。
Ⅱ.利用上述装置还可以验证醋酸、苯酚、碳酸的酸性强弱。
(1)A中固体试剂是 (选填序号);
A.醋酸钠 B.碳酸氢钠 C.苯酚钠
(2)C中反应的化学方程式是____________________________________;
(3)有同学认为没有B装置,也可以验证酸性的强弱,你认为合理吗?
_____(填“合理”或“不合理”);若不合理,原因是:
______________________________________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com