
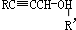
 .
.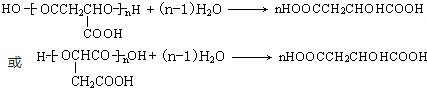 .
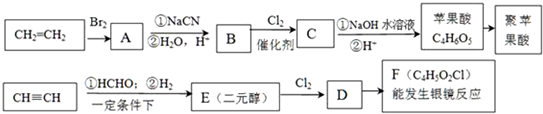
. 分析 苹果酸分子式为C4H6O5,0.l mol苹果酸与足量NaHCO3溶液反应能产生4.48L CO2(标准状况),二氧化碳的物质的量为0.2mol,则1mol苹果酸含2mol-COOH.苹果酸脱水能生成使溴水褪色的产物,结合苹果酸的分子式知,苹果酸的结构简式为:HOOCCH2CH(OH)COOH.苹果酸酯化反应进行的聚合生成聚苹果酸,其结构为 ,乙烯与溴发生加成反应生成A,则A为BrCH2CH2Br,A发生信息反应,先发生取代反应,再发生水解生成B,则B为HOOCH2CH2COOH,B与氯气发生取代反应生成C,结合苹果酸的结构可知,C为HOOCCH2CH(Cl)COOH,由F的分子式可知,乙炔与HCHO、氢气发生加成反应生成E,由题给信息可知E为HOCH2CH2CH2CH2OH,F能反应银镜反应,含有醛基-CHO,F经过系列转化生成苹果酸,结合苹果酸的结构与F的分子式,可知F为OHCCH2CH(Cl)CHO,结合C、F的结构可知,D为HOCH2CH2CH(Cl)CH2OH,根据有机物的结构和性质解答.
,乙烯与溴发生加成反应生成A,则A为BrCH2CH2Br,A发生信息反应,先发生取代反应,再发生水解生成B,则B为HOOCH2CH2COOH,B与氯气发生取代反应生成C,结合苹果酸的结构可知,C为HOOCCH2CH(Cl)COOH,由F的分子式可知,乙炔与HCHO、氢气发生加成反应生成E,由题给信息可知E为HOCH2CH2CH2CH2OH,F能反应银镜反应,含有醛基-CHO,F经过系列转化生成苹果酸,结合苹果酸的结构与F的分子式,可知F为OHCCH2CH(Cl)CHO,结合C、F的结构可知,D为HOCH2CH2CH(Cl)CH2OH,根据有机物的结构和性质解答.
解答 解:苹果酸分子式为C4H6O5,0.l mol苹果酸与足量NaHCO3溶液反应能产生4.48L CO2(标准状况),二氧化碳的物质的量为0.2mol,则1mol苹果酸含2mol-COOH.苹果酸脱水能生成使溴水褪色的产物,结合苹果酸的分子式知,苹果酸的结构简式为:HOOCCH2CH(OH)COOH.苹果酸酯化反应进行的聚合生成聚苹果酸,其结构为 ,乙烯与溴发生加成反应生成A,则A为BrCH2CH2Br,A发生信息反应,先发生取代反应,再发生水解生成B,则B为HOOCH2CH2COOH,B与氯气发生取代反应生成C,结合苹果酸的结构可知,C为HOOCCH2CH(Cl)COOH,由F的分子式可知,乙炔与HCHO、氢气发生加成反应生成E,由题给信息可知E为HOCH2CH2CH2CH2OH,F能反应银镜反应,含有醛基-CHO,F经过系列转化生成苹果酸,结合苹果酸的结构与F的分子式,可知F为OHCCH2CH(Cl)CHO,结合C、F的结构可知,D为HOCH2CH2CH(Cl)CH2OH,
,乙烯与溴发生加成反应生成A,则A为BrCH2CH2Br,A发生信息反应,先发生取代反应,再发生水解生成B,则B为HOOCH2CH2COOH,B与氯气发生取代反应生成C,结合苹果酸的结构可知,C为HOOCCH2CH(Cl)COOH,由F的分子式可知,乙炔与HCHO、氢气发生加成反应生成E,由题给信息可知E为HOCH2CH2CH2CH2OH,F能反应银镜反应,含有醛基-CHO,F经过系列转化生成苹果酸,结合苹果酸的结构与F的分子式,可知F为OHCCH2CH(Cl)CHO,结合C、F的结构可知,D为HOCH2CH2CH(Cl)CH2OH,
(1)根据上面的分析可知,B的结构简式为HOOCCH2CH2COOH,
故答案为:HOOCCH2CH2COOH;
(2)苹果酸的结构简式为:HOOCCH2CH(OH)COOH,苹果酸所含官能团的名称为羟基、羧基,F为OHCCH2CH(Cl)CHO,比较F和苹果酸的结构简式可知,F转化成苹果酸可能发生的反应类型为氧化反应、取代反应或水解反应,
故答案为:羟基、羧基;氧化反应、取代反应或水解反应;
(3)与苹果酸具有相同官能团的同分异构体的结构简式为 ,
,
故答案为: ;
;
(4)F为OHCCH2CH(Cl)CHO,F与足量银氨溶液反应的化学方程式OHCCH2CHClCHO+4 Ag(NH3)2OH$\stackrel{△}{→}$NH4OOCCH2CHClCOONH4+4Ag↓+6NH3+2H2O,
故答案为:OHCCH2CHClCHO+4 Ag(NH3)2OH$\stackrel{△}{→}$NH4OOCCH2CHClCOONH4+4Ag↓+6NH3+2H2O;
(5)C为HOOCCH2CH(Cl)COOH,C与NaOH溶液反应的化学方程式为HOOCCH2CHClCOOH+3NaOH$\stackrel{△}{→}$NaOOCCH2CH(OH)COONa+NaCl+2H2O,
故答案为:HOOCCH2CHClCOOH+3NaOH$\stackrel{△}{→}$NaOOCCH2CH(OH)COONa+NaCl+2H2O;
(6)聚苹果酸在生物体内水解的化学方程式为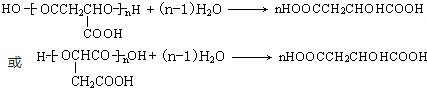 ,
,
故答案为: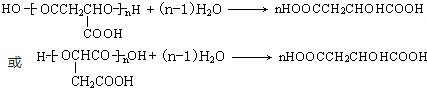 .
.
点评 本题考查有机物的推断与合成、对给予信息的利用、官能团的性质与转化,明确苹果酸的性质来推断其结构是解答本题的关键,注意根据反应信息进行推断,题目难度中等.


 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:解答题
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | ①是BaCl2溶液,②稀盐酸 | B. | ①是稀盐酸,②稀BaCl2溶液 | ||
| C. | ①是稀硝酸,②是AgNO3溶液 | D. | ①是稀硫酸,②是AgNO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙烯分子中有7个σ键,2个π键 | |
| B. | 在60 g SiO2晶体中,Si-O键的数目为2NA | |
| C. | 共价键有方向性,但无饱和性 | |
| D. | 由ⅠA族和ⅥA族元素形成的原子个数比为1:1、电子总数为38的化合物,是含有共价键的离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  干燥氯气 | B. |  检验K2CO3中的K+ | ||
| C. |  收集纯净的NH3并验满 | D. |  制备Fe(OH)2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com