
 +9O2$\stackrel{点燃}{→}$6CO2+6H2O.
+9O2$\stackrel{点燃}{→}$6CO2+6H2O. 分析 浓硫酸增重的5.4g为水的质量,则水的物质的量为:$\frac{5.4g}{18g/mol}$=0.3mol,则X分子中含有H原子数为:$\frac{0.3mol×2}{0.1mol}$=6,
将剩余气体通入足量的澄清石灰水中得到的60g沉淀为碳酸钙,根据C原子守恒可知0.1molX中含有C的物质的量为:$\frac{60g}{100g/mol}$=0.6mol,则X分子中含有C原子数为:$\frac{0.6mol}{0.1mol}$=6,所以X的分子式为:C6H6,X不能使酸性KMnO4溶液褪色,也不能与溴的四氯化碳溶液反应而使其褪色,则X分子中不存在碳碳双键,故X为苯;苯与氢气反应的方程式为: ,则Y为环己烷,据此进行解答.
,则Y为环己烷,据此进行解答.
解答 解:浓硫酸增重的5.4g为水的质量,则水的物质的量为:$\frac{5.4g}{18g/mol}$=0.3mol,则X分子中含有H原子数为:$\frac{0.3mol×2}{0.1mol}$=6;得到的60g沉淀为碳酸钙,根据C原子守恒可知0.1molX中含有C的物质的量为:$\frac{60g}{100g/mol}$=0.6mol,则X分子中含有C原子数为:$\frac{0.6mol}{0.1mol}$=6,所以X的分子式为:C6H6,X不能使酸性KMnO4溶液褪色,也不能与溴的四氯化碳溶液反应而使其褪色,则X分子中不存在碳碳双键,故X为苯,
(1)7.8g苯的物质的量为:$\frac{7.8g}{78g/mol}$=0.1mol,根据反应 可知,0.1mol苯完全反应消耗0.3mol氢气,则a=0.3,
可知,0.1mol苯完全反应消耗0.3mol氢气,则a=0.3,
故答案为:0.3;
(2)苯与浓硝酸在浓硫酸作用下发生取代反应生成硝基苯和水,反应的化学方程式:C6H6+HNO3$→_{△}^{浓硫酸}$C6H5NO2 +H2O,有机产物的名称为硝基苯,
故答案为:C6H6+HNO3$→_{△}^{浓硫酸}$C6H5NO2 +H2O;取代;硝基苯;
(3)苯与氢气发生加成反应生成环己烷,则Y为环己烷,环己烷燃烧的化学方程式为: +9O2$\stackrel{点燃}{→}$6CO2+6H2O,
+9O2$\stackrel{点燃}{→}$6CO2+6H2O,
故答案为: +9O2$\stackrel{点燃}{→}$6CO2+6H2O.
+9O2$\stackrel{点燃}{→}$6CO2+6H2O.
点评 本题考查了有机物分子式、结构简式的确定,题目难度中等,明确常见有机物结构与性质为解答关键,注意掌握质量守恒定律在确定有机物分子式中的应用方法.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 相对分子质量相同、结构不同的化合物一定互为同分异构体 | |
| B. | 含不同碳原子数的烷烃一定互为同系物 | |
| C. | 结构对称的烷烃,其一氯取代产物必定只有一种 | |
| D. | 分子通式相同且组成上相差一个或几个CH2原子团的物质互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 聚丙烯的结构简式: | B. | 四氯化碳分子的电子式: | ||
| C. | 2-乙基-1,3-丁二烯分子的键线式: | D. | 丙烷分子的比例模型: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=4的醋酸中:c(H+)=4.0molL-1 | |
| B. | 饱和小苏打溶液中:c(Na+)=c(HCO3-) | |
| C. | pH=12的纯碱溶液中:c(OH-)=1.0×10-2molL-1 | |
| D. | 饱和食盐水中:c(Na+)+c(H+)=c(Cl-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
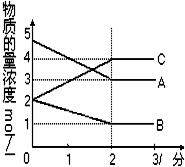 在密闭容器中,某反应在不同反应时间各物质的量的变化情况如图所示
在密闭容器中,某反应在不同反应时间各物质的量的变化情况如图所示 2C.
2C.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn为正极,碳为负极 | |
| B. | Zn为负极,碳极发生氧化反应 | |
| C. | 工作时,电子由碳极经过电路流向Zn极 | |
| D. | 长时间连续使用时,内装糊状物可能流出腐蚀用电器 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 孔雀石主要含Cu2(OH)2CO3,还含少量FeO、SiO2.以孔雀石为原料可制备CuSO4•5H2O步骤如图:
孔雀石主要含Cu2(OH)2CO3,还含少量FeO、SiO2.以孔雀石为原料可制备CuSO4•5H2O步骤如图:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 溶解性(本身均可做溶剂) | 沸点(℃) | 密度(g/mL) | |
| 乙醇 | 与水混溶,易溶于有机溶剂 | 78.5 | 0.8 |
| 溴乙烷 | 难溶于水,易溶于有机溶剂 | 38.4 | 1.4 |
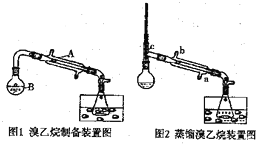
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com