

分析 含镍(Ni2+)废液为原料生产NiOOH,在含Ni+的废液中中加入碳酸钠溶液,过滤得到NiCO3沉淀,沉淀中加入硫酸溶解生成NiSO4,加入试剂调节溶液的pH使镍离子全部沉淀生成Ni(OH)2,在空气中加热Ni(OH)2制取NiOOH;
(1)确认Ni2+已经完全沉淀的实验方法是取上层清液,加入碳酸钠溶液观察是否有沉淀生成,判断镍离子是否全部沉淀;
(2)依据溶度积常数计算溶液中氢氧根离子浓度,结合离子积常数计算溶液中的氢离子浓度,pH=-lgc(H+);
(3)空气中加热Ni(OH)2和空气中氧气反应生成NiOOH和水;
(4)消耗KMnO4物质的量:0.01 mol•L-1×0.02L=2×10-4 mol,
与NiOOH反应后剩余的Fe2+物质的量:2×10-4 mol×5×(200÷20)=0.01 mol,
Fe2+总物质的量:1.0 mol•L-1×0.1 L=0.1 mol,
与NiOOH反应的Fe2+的物质的量:0.1 mol-0.01 mol=0.09 mol,
得到n(NiOOH)=0.09 mol,计算得到NiOOH的质量,得到混合物中Ni(OH)2的质量,计算物质的量,依据xNiOOH•yNi(OH)2计算x和y的比值.
解答 解:(1)确认Ni2+已经完全沉淀的实验方法是取上层清液,加入碳酸钠溶液观察是否有沉淀生成,判断镍离子是否全部沉淀,具体操作步骤为:静置,在上层清液中继续滴加1~2滴Na2CO3溶液,无沉淀生成;
故答案为:静置,在上层清液中继续滴加1~2滴Na2CO3溶液,无沉淀生成;
(2)已知Ksp[Ni(OH)2]=2×10-15,欲使NiSO4溶液中残留c(Ni2+)≤2×10-5 mol•L-1,Ksp[Ni(OH)2]=c(Ni2+)×c2(OH-)=2×10-15,c(OH-)=$\sqrt{\frac{2×1{0}^{-15}}{2×1{0}^{-5}}}$=10-5mol/L,c(H+)=$\frac{1{0}^{-14}}{1{0}^{-5}}$=10-9mol/L,则pH=9;
由于c(Ni2+)≤2×10-5 mol•L-1,则调节pH的范围是:pH≥9,
故答案为:pH≥9;
(3)空气中加热Ni(OH)2和空气中氧气反应生成NiOOH和水,原子守恒配平书写化学方程式为:4Ni(OH)2+O2$\frac{\underline{\;\;△\;\;}}{\;}$4NiOOH+2H2O,
故答案为:4Ni(OH)2+O2$\frac{\underline{\;\;△\;\;}}{\;}$4NiOOH+2H2O;
(4)消耗KMnO4物质的量:0.01 mol•L-1×0.02L=2×10-4 mol
与NiOOH反应后剩余的Fe2+物质的量:2×10-4 mol×5×(200÷20)=0.01 mol
Fe2+总物质的量:1.0 mol•L-1×0.1 L=0.1 mol
与NiOOH反应的Fe2+的物质的量:0.1 mol-0.01 mol=0.09 mol
n(NiOOH)=0.09 mol
m(NiOOH)=91.7 g•mol-1×0.09 mol=8.253 g
n[Ni(OH)2]=$\frac{9.18g-8.253g}{92.7g•mol-1}$=0.01mol,
x:y=n(NiOOH):n[Ni(OH)2]=0.09 mol:0.01 mol=9:1,
即x=9、y=1,
答:x、y的值分别为9、1.
点评 本题考查了物质分离方法和实验过程分析判断、溶度积常数和离子积常数的计算应用,题目难度中等,明确实验目的及化学实验基本操作方法为解答关键,试题培养了学生的分析能力及化学实验能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6.4 g | B. | 4.8 g | C. | 2.4 g | D. | 1.6 g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在盛有硫酸亚铁铵溶液的试管中,滴加几滴新制氯水,无明显现象,然后滴加KSCN溶液,若观察到溶液变为血红色,则说明硫酸亚铁铵中含有Fe2+ | |
| B. | 测量某溶液的pH,pH试纸一旦用水湿润,一定会产生实验误差 | |
| C. | 灼烧海带可以在坩埚中进行,也可以在蒸发皿中进行 | |
| D. | 实验室用已知浓度的醋酸溶液滴定未知浓度的氢氧化钠溶液时,选用酚酞做指示剂比用甲基橙做指示剂时带来的误差要小一点 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
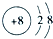
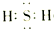
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1CH3COONa溶液与0.1 mol•L-1HCl溶液等体积混合:c(Na+)=c(Cl-)>c(CH3COO-)>c(H+) | |
| B. | 0.1 mol•L-1NH4Cl溶液与0.1 mol•L-1氨水等体积混合(pH>7):c(NH3•H2O)>c(NH4+)>c(Cl-)>c(OH-) | |
| C. | 0.1 mol•L-1Na2CO3溶液与0.1 mol•L-1NaHCO3溶液等体积混合:$\frac{2}{3}$c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| D. | 0.1 mol•L-1Na2C2O4溶液与0.1 mol•L-1HCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O42-)+c(HC2O4-)+c(OH-)=c(Na+)+c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.4L任何气体的物质的量均为1mol | |
| B. | 标准状况下,1mol物质的体积为22.4L | |
| C. | H2、O2、N2、CO2组成的混合气体1mol在标准状况下的体积约为22.4L | |
| D. | 在同温同压下,相同体积的任何气体单质所含分子数和原子数都相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+、Fe2+、Cl-、SO42- | B. | Mg2+、Fe3+、NO3-、SCN- | ||
| C. | K+、Na+、Cl-、HCO3- | D. | Na+、Ba2+、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
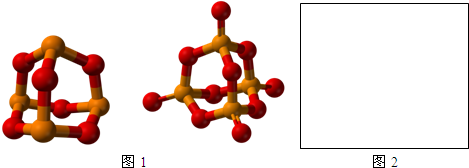
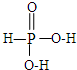 ,写出H3PO2与足量氢氧化钠溶液反应的化学方程式NaOH+H3PO2=Na H2PO2+H2O.磷的三种含氧酸H3PO2、H3PO3、H3PO4的酸性强弱顺序为H3PO2<H3PO3<H3PO4,其原因是H3PO2、H3PO3、H3PO4中磷元素的化合价依次为+1,+3和+5价,中心磷原子的正电荷依次升高,导致P-O-H中O的电子更易向P偏移,因而H3PO2、H3PO3、H3PO4越易电离出氢离子,酸性越来越强.
,写出H3PO2与足量氢氧化钠溶液反应的化学方程式NaOH+H3PO2=Na H2PO2+H2O.磷的三种含氧酸H3PO2、H3PO3、H3PO4的酸性强弱顺序为H3PO2<H3PO3<H3PO4,其原因是H3PO2、H3PO3、H3PO4中磷元素的化合价依次为+1,+3和+5价,中心磷原子的正电荷依次升高,导致P-O-H中O的电子更易向P偏移,因而H3PO2、H3PO3、H3PO4越易电离出氢离子,酸性越来越强.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com