
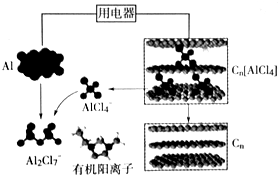
| A. | 充电时,Al做阴极、Cn为阳极 | |
| B. | 充电时,每生成1mol铝,同时消耗4molAl2Cl7- | |
| C. | 放电时,电解质中的有机阳离子向铝电极方向移动 | |
| D. | 放电时,正极反应式为Cn[AlCl4]+e-=Cn+AlCl4- |
分析 由示意图可知放电时铝为负极,被氧化生成Al2Cl7-,电极方程式为Al+7AlCl4--3e-═4Al2Cl7-,正极反应为3Cn[AlCl4]+3e-=3Cn+3AlCl4-,电解时阳极发生氧化反应,电解方程式为Cn+AlCl4--e-═Cn[AlCl4],阴极发生还原反应,电极方程式为4Al2Cl7-+3e-=Al+7AlCl4-,以此解答该题.
解答 解:A.放电时,铝是活泼的金属铝是负极,被氧化生成Al2Cl7-,不活泼石墨为正极,充电时,Al做阴极、Cn为阳极,故A正确;
B.充电时,在阴极上的电极反应式为:4Al2Cl7-+3e-=Al+7AlCl4-,每生成1mol铝,同时消耗4molAl2Cl7-,故B正确;
C.放电时,原电池中阳离子向正极移动,铝是负极,故C错误.
D.放电时,正极发生得电子的还原反应,电极反应式为:Cn[AlCl4-]+e-=Cn+AlCl4-,故D正确;
故选C.
点评 本题考查学生二次电池的工作原理以及原电池和电解池的工作原理知识,为高频考点,侧重学生的分析能力的考查,属于综合知识的考查,难度中等,注意把握电极的判断方法和电极方程式的书写.


 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 乙烯能使酸性高锰酸钾溶液褪色 | |
| B. | 苯能使酸性高锰酸钾溶液褪色 | |
| C. | 乙醇可以和金属钠反应放出氢气 | |
| D. | 乙酸可以与乙醇在一定条件下发生酯化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.1 g | B. | 27.2 g | C. | 30 g | D. | 14.6 g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁粉溶解,没有任何金属生成 | B. | 铁粉未完全溶解 | ||
| C. | 析出0.1mol 银和0.1mol 铜 | D. | 析出0.1mol 银和0.05mol 铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. .
.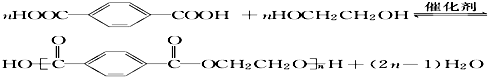 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
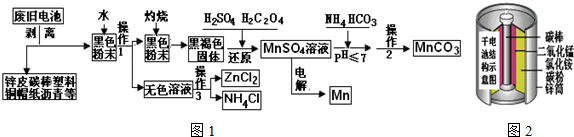
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3OH的燃烧热为192.9 kJ•mol-1 | |
| B. | CH3OH的燃烧热为676.7 kJ•mol-1 | |
| C. | CH3OH转变成H2的过程一定要吸收能量 | |
| D. | 根据②推知反应:CH3OH(l)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g)的△H>-192.9kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液氧、稀硫酸、氨气 | B. | 干冰、氢氧化镁、氢氧化铁胶体 | ||
| C. | 冰、氯化钠固体、乙醇 | D. | 生石灰、熟石灰、石灰石 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 澄清透明的无色溶液:K+、NH4+、MnO4-、HCO3- | |
| B. | 0.10 mol•L-1 KI溶液:Al3+、Fe3+、Cl-、SO42- | |
| C. | 滴入甲基橙变红色的溶液:Na+、Ca2+、NO3-、Cl- | |
| D. | c(H+)=1×10-12 mol•L-1的溶液:Mg2+、Cu2+、NO3-、SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com