
����Ŀ���±���ǰ20��Ԫ���еIJ���Ԫ�ص�һЩ���ݣ�
A | B | C | D | E | F | G | H | I | J | |
ԭ�Ӱ뾶(10-10m) | 1.02 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 1.17 |
���̬ | +6 | +1 | �� | +3 | +4 | +5 | +7 | +1 | +5 | +4 |
��ͼ�̬ | -2 | �� | -2 | �� | -4 | -3 | -1 | �� | -3 | -4 |
�Իش��������⣺
(1)����10��Ԫ�ص縺��������_____(��Ԫ�ط���)����Ԫ��Bԭ��������7��Ԫ����Ԫ�����ڱ��е�λ�ã���_____���ڣ���_____�壬���̬ԭ�ӵĺ�������Ų�ʽ��________��
(2)H��I��J����Ԫ�ض�Ӧ���ʵ��۵��������ߵ�˳����(�õ��ʵľ��廯ѧʽ����)__________��
(3)Ԫ��E��C����Ԫ�ؿ��γ�һ����Է�������Ϊ60��һԪ������ӡ�������й��γ�________���Ҽ���________���м���
(4)I����Ԫ���γɵ�10���ӷ���X�Ŀռ乹��Ϊ________����X����ˮ�����Һ���뵽CuSO4��Һ�����������õ��������ӵĻ�ѧʽΪ________������X��Cu2+֮����_____________����ϡ�
(5)��ͼ��IԪ���γɵĺ�����Ľṹ�����Ҫ˵��������������ˮ��ԭ��
a._________________________________��
b._________________________________��
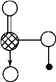
(6) ��ͼ��J��E��ɵľ���ṹ����ÿ����J��Χ���Jԭ����ĿΪ_________���������߳�Ϊa cm��������ܶ�Ϊ_______________���ú�a��NA�Ĵ���ʽ��ʾ��(g/mL)��

���𰸡� O 4 VIII 1s22s22p63s23p63d64s2(��[Ar]3d64s2) N2 <Na< Si 7 1 ������ [Cu (NH3)4]2�� ��λ HNO3�Ǽ��Է��ӣ������ڼ��Ե�ˮ�� HNO3�����еģ�OH����ˮ����֮���γ���� 12 ![]() ��
�� ![]() ��
��![]()
��������ǰ20��Ԫ���У�AC������ͼ�-2������VIA�壬A��+6�ۣ�Cֻ��-2�ۣ���AΪS��CΪOԪ�أ�E��J����+4��-4�ۣ�����IVA�壬E��ԭ�Ӱ뾶��С����E��CԪ�ء�J��Si��F��I����+5��-3�ۣ�����VA�壬F��ԭ�Ӱ뾶����I����F��PԪ�ء�I��NԪ�أ�G��+7��-1�ۣ�Ϊ��A��Ԫ�أ�G��ClԪ�أ�Dֻ��+3�ۣ�Ϊ��A��Ԫ�أ�ԭ�Ӱ뾶����Siԭ�Ӱ뾶������D��AlԪ�أ�B��H�������Ϊ+1��û�и��ۣ�����IA�壬B��ԭ�Ӱ뾶��Alԭ�Ӱ뾶��ܶ࣬���ܴ���ͬ���ڣ���BΪK��B��Hԭ�Ӱ뾶����̫��Ӧ���ڣ���HΪNa��
(1)ͬ����������ҵ縺�Գ��������ƣ�ͬ�������϶��µ縺�Լ�С��������Ԫ���е縺������Ԫ������Ԫ�أ���Ԫ��Bԭ��������7��Ԫ��ΪFe�����ڵ�������VIII�壻��̬ԭ�Ӻ�������Ų�Ϊ��1s22s22p63s23p63d64s2(��[Ar]3d64s2)���ʴ���Ϊ��O��4��VIII��1s22s22p63s23p63d64s2(��[Ar]3d64s2)��
(2)HΪNa��I��N��J��Si���䵥�ʵ��۵��������ߵ�ΪN2��Na��Si���ʴ�Ϊ��N2��Na��Si��
(3)̼Ԫ�ء���Ԫ�ؼ���Ԫ�ؿ��γ�һ����Է�������Ϊ60��һԪ������ӣ�������ΪCH3COOH��������й��γ�7��������1���������ʴ�Ϊ��7��1��
(4)XΪNH3��NH3�е�ԭ�ӵļ۲���Ӷ���Ϊ![]() =4����һ�Թµ��Ӷԣ�����NH3�ռ乹��Ϊ�����Σ���NH3����ˮ�����Һ���뵽CuSO4��Һ�����������õ������ӵĻ�ѧʽΪ[Cu(NH3)4]2+������NH3��Cu2+֮������λ����ϣ��ʴ�Ϊ�������Σ�[Cu(NH3)4]2+����λ��
=4����һ�Թµ��Ӷԣ�����NH3�ռ乹��Ϊ�����Σ���NH3����ˮ�����Һ���뵽CuSO4��Һ�����������õ������ӵĻ�ѧʽΪ[Cu(NH3)4]2+������NH3��Cu2+֮������λ����ϣ��ʴ�Ϊ�������Σ�[Cu(NH3)4]2+����λ��
(5)ͼ1�еĺ�����ΪHNO3��HNO3������ˮ��ԭ��a��HNO3�Ǽ��Է��ӣ������ڼ��Ե�ˮ�У�b��HNO3�����е�-OH����ˮ����֮���γ�������ʴ�Ϊ��HNO3�Ǽ��Է��ӣ������ڼ��Ե�ˮ�У�HNO3�����е�-OH����ˮ����֮���γ������
(6)J��Si��E��C���Ծ��������ϵ�SiΪ������֮���������SiΪ12��������Siԭ����ĿΪ8��![]() +6��
+6��![]() =4��������Cԭ����ĿΪ4�������߳�Ϊacm���������Ϊa3��������ܶ�Ϊ
=4��������Cԭ����ĿΪ4�������߳�Ϊacm���������Ϊa3��������ܶ�Ϊ![]() g/mL=
g/mL=![]() g/mL=
g/mL=![]() g/mL���ʴ�Ϊ��12��
g/mL���ʴ�Ϊ��12�� ![]() ��
��![]() ��
��


 ���ƿ�����ϵ�д�
���ƿ�����ϵ�д� ���¿쳵����������ϵ�д�
���¿쳵����������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A.Ħ����һ��������B.��״���µ�����Ħ�����ԼΪ22.4 L
C.CO2��Ħ��������44gD.500mL0.1mol/L AlCl3��Һ��Cl����Ũ��Ϊ0.3mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ��ҵSO2��������Ӧ�����е�����(v)��ʱ��(t)�Ĺ�ϵ���ߣ�����������ȷ���ǣ� ��

A. t2-t3�����������ʵ������ֲ���(��֪��������SO3Ϊ����)
B. t2ʱ��v(SO2)����v(O2)������ҵ���0
C. t1ʱ�̣�ֻ��������ķ�Ӧû���淽��ķ�Ӧ
D. t2-t3�����ھ�ֹ״̬����Ӧ���ٷ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A. ���������ж����Ͻ��������ӵ��κ�ʳƷ��������
B. ���ſ������ռ�NO
C. �ü���Ũ��ˮ�ķ������Կ����ư��������Ȼ��Ƹ����õ������İ���
D. 8NH3+3Cl2=6NH4Cl+N2����˿�����Ũ��ˮ���������Ĺܵ��Ƿ�©��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и����е����ʱȽϣ�����ȷ����
A. ���ԣ�HClO4��H2SO4��H3PO4 B. �ȶ��ԣ�NH3��PH3��SiH4
C. ���ԣ�KOH��NaOH��Mg��OH��2 D. ��ԭ�ԣ�F����Cl����Br��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±��Dz�ͬ�¶���ˮ�����ӻ����ݣ�

�Իش��������⣺
��1����25��t1��t2����a___1��10-14 (��������������������=�����������жϵ�������______��
��2��25���£�ijNa2SO4��Һ��c(SO42-)=5��10-4 mol��L��1��ȡ����Һ1mL��ˮϡ����10mL����ϡ�ͺ���Һ��c(Na+):c(OH-)=__________��
��3����t2���£�pH=10��NaOH��Һ�У�ˮ���������OH-ΪŨ��Ϊ_________��
��4��t2���£���pH=11��NaOH��ҺV1L��pH=1��ϡ����V2L��ϣ����Ϻ���Һ�����Ϊԭ����Һ���֮�ͣ������û����Һ��pH=2����V1:V2=________��
��5����H+Ũ����ͬ�������ȵ������a������ b������ c�����ᣬͬʱ����������п����ʼ��Ӧʱ���ʴ�С˳��Ϊ_____����Ӧ��ȫ������H2��������С��ϵΪ____����abc��ʾ�ᣩ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ���ϸ��ijЩ�ṹ����Ҫ��ɳɷ֣���ĸ��Ԫ�ط��ţ�������������ȷ���ǣ��� ��

A. �ṹ1���ܵĸ��ӳ̶���Ҫ����ͼ���ҵ����������ֱ�Ӿ�����
B. �����ҡ����ĵ���ֱ��ǰ�����ͺ��Ǻ�����
C. ԭ��ϸ���ṹ1���������ҡ�������
D. �����ϸ�����Ŵ�������Ҫ�DZ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л�ѧ��Ӧ�������û���Ӧ������������ԭ��Ӧ���ǣ� ��
A.CuO+CO ![]() Cu+CO2
Cu+CO2
B.Fe+H2SO4�TFeSO4+H2��
C.3Fe+4H2O��g�� ![]() Fe3O4+4H2
Fe3O4+4H2
D.4NH3+3O2 ![]() 2N2+6H2O
2N2+6H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������7�����ʣ���NaOH����NaHCO3����HCl����CH3COOH����C2H5OH����Al����ʳ��ˮ��
��1����������������ǿ����ʵ���________(�����)������������ʵ���________(�����)�����ڷǵ���ʵ���________(�����)�����ܸ����ᷴӦ���ܸ�NaOH��Һ��Ӧ����____________(�����)��
��2����������ˮ��Һ�ʼ��Ե�ԭ����(�����ӷ���ʽ��ʾ) ______________________��
��3����������ˮ��Һ�����Ե�ԭ����(�����ӷ���ʽ��ʾ)__________________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com