
H2O2+Cr2(SO4)3+________——K2SO4+K2CrO4+H2O
科目:高中化学 来源: 题型:阅读理解
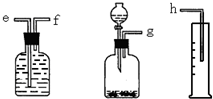 (1)测定Na2O和Na的混合物中金属钠的质量分数可用下图所示的几套仪器组合:
(1)测定Na2O和Na的混合物中金属钠的质量分数可用下图所示的几套仪器组合:查看答案和解析>>
科目:高中化学 来源: 题型:
(1)K2Cr2O7+HCl(浓)——KCl+CrCl3+Cl2↑+H2O
(2)Cu2++FeS2+□□——Cu2S+![]() +Fe2++□□
+Fe2++□□
(3)将NaBiO3固体(黄色,微溶)加入MnSO4和H2SO4的混合溶液里,加热,溶液显紫色(Bi3+无色)。配平该反应的离子方程式:NaBiO3+□Mn2++□H+![]() □Na++□Bi3++□□+□□
□Na++□Bi3++□□+□□
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
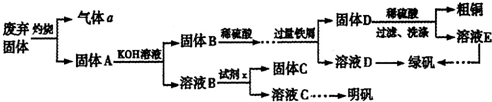
查看答案和解析>>
科目:高中化学 来源:浙江省模拟题 题型:实验题
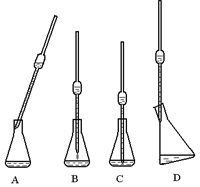
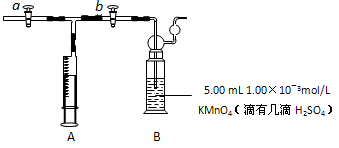
查看答案和解析>>
科目:高中化学 来源:2013年山东省淄博市高考化学二模试卷(解析版) 题型:解答题
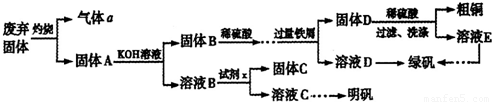
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com