
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.1 | 8.8 | 11.6 | 10.3 | 11.1 | 11.3 |
分析 (1)①六种盐都为强碱弱酸盐,盐的pH越大,说明对应的酸水解程度越大,则对应的酸越弱,根据强酸生成弱酸的特点判断反应能否进行;
②根据反应H2B(少量)+2A-=B2-+2HA,可知,HA酸性小于H2B,HA酸性最弱,酸性越弱,对应的酸根离子得H+能力越强;
(2)复分解反应中有一种条件是生成难溶物质,由②③可以看出,在饱和溶液中,可生成溶解度更小的物质;
(3)溶液中的c(H+)=10-9mol.L-1,说明溶液呈碱性;
(4)一水合氨为弱电解质,不能完全电离,pH相同时,氨水浓度最大;
(5)CH3COONa为强碱弱酸盐,水解呈碱性,且水解程度较小,加水稀释时,浓度减小同时促进水解,但pH变化不大;向等体积纯水中分别加入等物质的量的CH3COONa和NaCN,NaCN水解程度比大CH3COONa,结合溶液电中性原则分析.
解答 解:(1)根据“越弱越水解”并结合表格数据知,酸性的强弱顺序为CH3COOH>H2CO3>HClO>HCN>C6H5OH>HCO3-.
①A.醋酸比氢氰酸的酸性强,醋酸与氢氰酸钠反应生成醋酸钠和氢氰酸,能发生,故A正确;
B.正确的反应方程式为NaClO+CO2+H2O═NaHCO3+HClO,故B正确;
C.氢氰酸的酸性比碳酸弱,不能用氢氰酸制备碳酸,故C错误;
D.苯酚的酸性比碳酸氢根离子的强,比碳酸的弱,苯酚与碳酸钠反应生成苯酚钠和碳酸氢钠,故D正确;.
E.因为次氯酸的酸性比碳酸氢根离子强,故碳酸钠与次氯酸不能共存,故E错误.
故答案为:CE;
②由反应知电离出H+能力的顺序:H2B>HB->HA,阴离子结合H+能力的难易顺序为A->B2->HB-.故答案为:A->B2->HB-;
(2)①Ca(OH)2+Na2CO3═CaCO3↓+2NaOH,氢氧化钙微溶于水,碳酸钙难溶于水.即由微溶物生成难溶物;②NH4HCO3+NaCl═NaHCO3↓+NH4Cl,碳酸氢铵、氯化钠的溶解度大于碳酸氢钠;③KCl+NaNO3═KNO3+NaCl↓,在一定的温度范围内,氯化钾、硝酸钠的溶解度大于氯化钠.由此得出的规律是,化学反应一般是由溶解度较大的物质向生成溶解度较小的物质的方向进行.
故答案为:由溶解度相对较大的物质向生成溶解度相对较小的物质的方向进行;
(3)溶液中c(H+)=10-9 mol•L-1,pH=9,溶液呈碱性,题述五种物质溶于水,只有硫化钠和氢氧化钠的水溶液呈碱性,故答案为:AD;
(4)pH=3的盐酸中c(H+)=10-3 mol•L-1,与①溶液混合后,由于氯化铵溶液呈酸性,故要使氨水和氯化铵的混合溶液呈中性,则需b>a;②溶液中,一水合氨是弱碱,氨水中有大量的一水合氨分子,故氨水的浓度大于1.0×10-3 mol•L-1,要使混合溶液呈中性,则需c<a;③溶液中,强酸与强碱反应,H+与OH-的物质的量相等,溶液呈中性,则d=a.综上所述,b>a=d>c.
故答案为:b>a=d>c;
(5)CH3COOH的电离程度大于CH3COONa的水解程度,水解程度越小,稀释时pH的变化越小,故醋酸钠溶液pH的变化最小.HCN的酸性比CH3COOH的酸性弱,由越弱越水解知,醋酸钠的水解程度小于氢氰酸钠的水解程度,CN-+H2O HCN+OH-,CH3COO-+H2O
HCN+OH-,CH3COO-+H2O CH3COOH+OH-,CH3COONa溶液中c(Na+)+c(H+)=c(CH3COO-)+c(OH-),NaCN溶液中c(Na+)+c(H+)=c(CN-)+c(OH-),Kw=c(H+)•c(OH-),钠离子的浓度不变且相等,CN-的水解程度较大,溶液中OH-的浓度较大,H+的浓度较小,故阳离子的浓度之和较小,任何电解质溶液中存在电荷守恒式,故n1>n2.
CH3COOH+OH-,CH3COONa溶液中c(Na+)+c(H+)=c(CH3COO-)+c(OH-),NaCN溶液中c(Na+)+c(H+)=c(CN-)+c(OH-),Kw=c(H+)•c(OH-),钠离子的浓度不变且相等,CN-的水解程度较大,溶液中OH-的浓度较大,H+的浓度较小,故阳离子的浓度之和较小,任何电解质溶液中存在电荷守恒式,故n1>n2.
故答案为:③;>.
点评 本题考查弱电解质电离及复分解反应条件,同时考查学生分析问题并总结归纳能力,明确酸的强弱及酸根离子水解程度关系、强酸能够制取弱酸即可解答,难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题

| A. | 装置①可用于实验室制取乙酸乙酯 | |
| B. | 装置②可用于分离苯和硝基苯的混合物 | |
| C. | 装置③可用于以苯为原料萃取碘水中的碘 | |
| D. | 装置④可用于实验室制取乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 负极的电极反应式为2I--2e-═I2 | |
| B. | 正极的电极反应式为AsO43-+2H++2e-?AsO33-+H2O | |
| C. | 利用酸度计(ph计)测定溶液的pH,若溶液的pH不再发生变化,应达到平衡 | |
| D. | 利用该反应设计原电池,利用毫安表测定电池的电流强度,当电池达到最大时,反应达到平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C0(NH2)2 | B. | NH4NO3 | C. | NH4HCO3 | D. | (NH4)2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
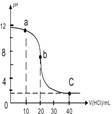
| A. | a点时,溶液呈碱性,溶液中c(B+)>c(Cl-) | |
| B. | b点时溶液的pH=7 | |
| C. | 当c(B+)=c(Cl-)时,v(HCl)<20mL | |
| D. | c点时溶液的c(H+)约为0.03mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
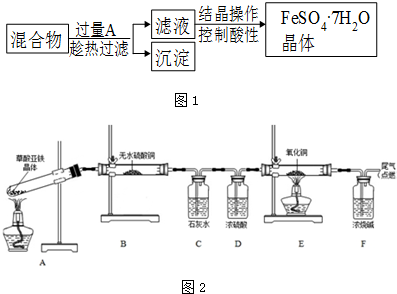
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com