
 。
。科目:高中化学 来源: 题型:
| 选项 | 现象或反应 | 原理解释 |
| A | 水在高温下难分解 | 水分子之间存在氢键 |
| B | 铝箔在酒精灯火焰上加热熔化但不滴落 | Al2O3熔点高于Al单质 |
| C | 向氯化银的悬浊液中加入KI生成黄色沉淀 | Ksp(AgI)<Ksp(AgCl) |
| D | 2CO=2C+O2在任何条件下均不能自发进行 | 该反应△H>0,△S<0 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| 500℃.30MPa |
| A、全部 | B、②⑤ |
| C、②③④⑦ | D、②④⑦ |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年辽宁省高三上学期12月月考化学试卷(解析版) 题型:选择题
下列说法正确的是
A.NaHCO3溶液和NaAlO2溶液混合会放出CO2
B.向沸水中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体
C.能使润湿的淀粉KI试纸变成蓝色的物质一定是Cl2
D.AlCl3溶液和NaAlO2溶液加热蒸干、灼烧都得到Al2O3
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省高三上学期期中考试化学试卷(解析版) 题型:填空题
硼镁泥是一种工业废料,主要成份是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业。从硼镁泥中提取MgSO4·7H2O的工艺流程如下:
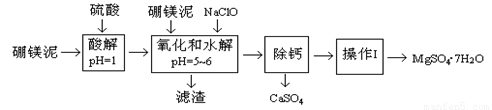
已知:NaClO与Mn2+反应产生MnO2沉淀。
|
沉淀物 |
Fe(OH)3 |
Al(OH)3 |
Fe(OH)2 |
|
开始沉淀pH |
2.3 |
4.0 |
7.6 |
|
完全沉淀pH |
4.1 |
5.2 |
9.6 |
根据题意回答下列问题:
(1)实验中需用1.00mol/L的硫酸80.0mL,若用98%的浓硫酸配制,除量筒、玻璃棒、胶头滴管外,还需要的玻璃仪器有 、 。
(2)滤渣的主要成份除含有Fe(OH)3、Al(OH)3外,还有 、 。
(3)加入的NaClO可与Mn2+反应产生MnO2沉淀,该反应的离子方程式: 。
在调节pH=5~6之前,还有一种离子也会被NaClO氧化,该反应的离子方程式为:
。
(4)为了检验滤液中Fe3+是否被除尽,可选用的试剂是 。
A.KSCN溶液 B.淀粉KI溶液 C.H2O2 D.KMnO4稀溶液
(5)已知MgSO4、CaSO4的溶解度如下表:
|
温度(℃) |
40 |
50 |
60 |
70 |
|
MgSO4 |
30.9 |
33.4 |
35.6 |
36.9 |
|
CaSO4 |
0.210 |
0.207 |
0.201 |
0.193 |
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明操作步骤 、 。
(6)如果测得提供的硼镁泥的质量为100.0g,得到的MgSO4·7H2O196.8g,则MgSO4·7H2O的产率为 (相对分子质量:MgSO4·7H2O-246 MgO-40)。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年江苏省泰州市高三第一次模拟考试化学卷 题型:实验题
(12分)本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容,请选择其中—题,并在相应的答题区域作答。若两题都做,则按A题评分。
A.镁、铜等金属离子是人体内多种酶的辅因子。工业上从海水中提取镁时,先制备无水氯化镁,然后将其熔融电解,得到金属镁。
(1)请参考下述数据填空和回答问题:
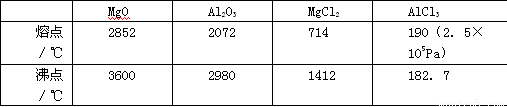
工业上常用电解熔融MgCl2的方法生产金属镁,电解Al2O3与冰晶石熔融混合物的方法生产铝。不用电解MgO的方法生产镁的原因 ;不用电解AlCl3的方法生产铝的原因 。
(2)2001年曾报道,硼镁化合物刷新了金属化合物超导温度的最高记录。该化合晶体结构中的晶胞如图所示。镁原子间形成正六棱柱,六个硼原子位于棱柱内。则该化合物的化学式可表示为 。

(3)写出Cu+的核外电子排布式 。
(4)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是 。
(5)某喹喏酮类药物(中心离子是Cu2+)结构如下图,关于该药物的说法正确的是 。
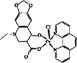
A.中心离子Cu2+的配位数是5
B.N原子均采用sp2杂化
C.存在配位键、极性共价键和非极性共价键
D.熔点很高,硬度很大
B.某化学研究性学习小组为探究某品牌花生油中不饱和脂肪酸的含量,进行了如下实验:
步骤I:称取0.4 g花生油样品,置于两个干燥的碘瓶(如图)内,加入10 mL四氯化碳,轻轻摇动使油全部溶解。向碘瓶中加入25.00 mL含0.01 mol IBr的无水乙酸溶液,盖好瓶塞,在玻璃塞与瓶口之间滴加数滴10%碘化钾溶液封闭缝隙,以免IBr的挥发损失。

步骤II:在暗处放置30 min,并不时轻轻摇动。30 min后,小心地打开玻璃塞,用新配制的10%
碘化钾10 mL和蒸馏水50 mL把玻璃塞和瓶颈上的液体冲洗入瓶内。
步骤Ⅲ:加入指示剂,用0.1 mol·L-1硫代硫酸钠溶液滴定,用力振荡碘瓶,直至终点。
测定过程中发生的相关反应如下:
①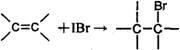
②IBr+KI=I2+KBr
③I2+2S2O32-=2I-+S4O62-
请回答下列问题:
(1)已知卤素互化物IBr的性质与卤素单质类似,实验中准确量取IBr溶液应选用的仪器是 ,碘瓶不干燥会发生反应的化学方程式 。
(2)步骤Ⅱ中碘瓶在暗处放置30 min,并不时轻轻摇动的原因是 。
(3)步骤Ⅲ中所加指示剂为 ,滴定终点的现象 。
(4)反应结束后从液体混合物中回收四氯化碳,所需操作有 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com