
| A. | Co2O3 | B. | Co3O3 | C. | Co3O4 | D. | Co5O7 |
分析 先计算出钴的总的质量分数,然后可得出该氧化物中氧元素的质量分数,然后利用n=$\frac{m}{M}$分别计算出钴、O原子的物质的量之比,从而可知其化学式.
解答 解:钴的氧化物含+2价钴24.48%,+3价钴48.9%,则该氧化物中含有钴元素的总质量分数为:24.48%+48.96%=73.44%,该氧化物中含有氧元素的质量数为:1-73.44%=26.56%,
所以该氧化物中Co与O的原子个数之比为:$\frac{73.44%}{59}$:$\frac{26.56%}{16}$=3:4,
所以该钴的氧化物的化学式为:Co3O4,
故选Co3O4.
点评 本题考查了物质化学式的确定,题目难度不大,明确元素质量分数的含义为解答关键,注意掌握相对原子量与质量分数的关系,试题培养了学生的化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 漂白粉变质后的残留固体有碳酸钙 | |
| B. | 实验室可用浓硫酸干燥硫化氢 | |
| C. | 将稀氨水滴到氢氧化钠溶液中可以制取氨气 | |
| D. | 单质氯气及单质硫与铁反应生成的产物中,铁的化合价相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
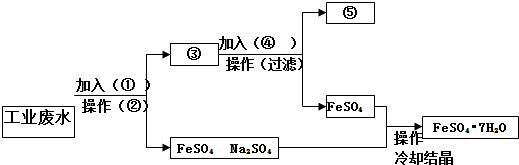
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 70 | 66 |
| 主要化合价 | +2 | +3 | +5、+3、-3 | -2 |
| A. | X单质、Y单质工业上均用电解其氧化物法得来 | |
| B. | Z、W两元素形成的不同化合物,Z的化合价一定不同 | |
| C. | Y的氧化物能与酸反应也能与碱反应,所以既是酸性氧化物又是碱性氧化物 | |
| D. | 一定条件下,W单质可以将Z单质从其氢化物中置换出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3的电离方程式:NaHCO3═Na++H++CO32- | |
| B. | CaCO3的沉淀溶解平衡表达式:CaCO3(s)?Ca2+(aq)+CO32-(aq) | |
| C. | NaHS发生水解的离子方程式:HS-+H2O?S2-+H3O+ | |
| D. | 碳酸的电离方程式:H2CO3?2H++CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
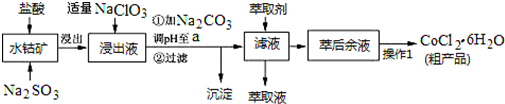
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
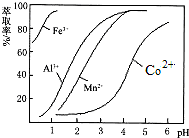
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在一密闭容器中发生反应N2+3H2?2NH3,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:
在一密闭容器中发生反应N2+3H2?2NH3,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
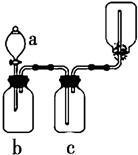 下图装置可用于制取、并收集表格中的四种气体(a、b、c表示相应仪器中加入的试剂)其中可行的是 ( )
下图装置可用于制取、并收集表格中的四种气体(a、b、c表示相应仪器中加入的试剂)其中可行的是 ( )| 选项 | 气体 | a | b | c |
| A | NO2 | 浓硝酸 | 铜片 | NaOH溶液 |
| B | SO2 | 浓硫酸 | 铜片 | 酸性KMnO4溶液 |
| C | NH3 | 浓氨水 | 生石灰 | 碱石灰 |
| D | CO2 | 稀盐酸 | 碳酸钙 | 浓硫酸 |
| A. | A | B. | B | ||
| C. | C D.D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,1LpH=12的Ba(OH)2溶液中含有的OH-数目为0.02NA | |
| B. | 室温下,14.0g乙烯和丁烯的混合气体中含有的C-H键数目为2NA | |
| C. | 0.1molFe在0.1molCl2中充分燃烧,转移的电子数为0.3NA | |
| D. | 标准状况下,22.4LCCl4中含有的分子数目为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com