
【题目】设![]() 为阿伏加德罗常数的值,下列叙述正确的是( )
为阿伏加德罗常数的值,下列叙述正确的是( )
A.某温度下,78 g ![]() 与适量的
与适量的![]() 恰好完全反应,转移的电子数为
恰好完全反应,转移的电子数为![]()
B.苯与液溴反应生成1 mol溴苯,消耗0.5![]() 个
个![]()
C.![]() 的
的![]() 溶液中,含有
溶液中,含有![]() 的数目为
的数目为![]()
D.100 g 46%的乙醇溶液中,含H—O键的数目为![]()
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知酸性K2Cr2O7溶液可与FeSO4溶液反应生成Fe3+和Cr3+。现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示,下列说法中不正确的是
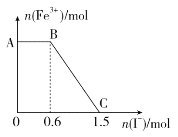
A. 图中AB段的氧化剂为K2Cr2O7
B. 开始加入的K2Cr2O7为0.25 mol
C. K2Cr2O7与FeSO4反应的物质的量之比为1∶3
D. 图中BC段发生的反应为2Fe3++2I-===2Fe2++I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)基态Fe2+的核外电子排布式为_______________,基态Ti3+的未成对电子有_____个。
(2)1mol[Ni(CO)4]2+ 中,配离子中含有σ键数目为________________
(3)有机物 HCHO的VSEPR构型为_______________。(填名称)
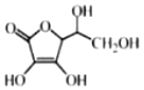
(4)抗坏血酸的分子结构如图所示,该分子中碳原子的轨道杂化类型为_________、____________
(5)向硫酸铜溶液中逐滴加入氨水先产生沉淀,后沉淀溶解为深蓝色溶液,请根据实验现象写出有关反应的离子方程式______________; ________。
(6)已知:下列物质断开1mol共价键吸收的能量或形成1mol共价键释放的能量数据如表:
共价键 | H﹣H | N﹣H | N≡N |
能量变化/kJmol﹣1 | 436 | 390.8 | 946 |
则合成氨反应:N2(g)+3H2 (g)=2NH3(g)△H=_________kJmol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科研人员研究了在 Cu-ZnO-ZrO2 催化剂上CO2加氢制甲醇过程中水的作用机理,其主法错误的是
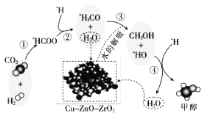
A.第①步中CO2和H2分子中都有化学键断裂
B.第③步的反应式为:*H3CO+H2O→CH3OH+*HO
C.第④步反应是一个放热过程
D.水在整个历程中可以循环使用,整个过程不消耗水也不产生水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图装置测定中和热的实验步骤如下:
①用量筒量取50mL0.25mol/L硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50mL0.55mol/LNaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度。
回答下列问题:

(1)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热数值为57.3kJ/mol): ______;
(2)学生甲用稀硫酸与稀烧碱溶液测定中和热装置如图。
①实验时所需要的玻璃仪器除烧杯、量筒外还需要:____。
②该装置中有一处错误是:_____。
(3)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会____(填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验现象和结论或原因相符![]() 是( )
是( )
操作及现象 | 原因或结论 | |
A | 一块表面打磨过的铝箔在酒精灯上加热至熔化,液态铝不会滴落 | 铝的熔点高于三氧化二铝 |
B | 某溶液中先加入稀盐酸,再加入加入硝酸银产生白色沉淀 | 原溶液中一定含有Cl- |
C | 用洁净铂丝蘸取某溶液在火焰上灼烧,火焰呈黄色 | 溶液中有Na+,无K+ |
D | 向氢氧化钠溶液中加入适量硫酸亚铁溶液,白色沉淀迅速变成灰绿色,最后变成红褐色 | 生成的氢氧化亚铁沉淀不稳定,容易被氧气氧化成氢氧化铁 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】广州大学附属东江中学“探源致善”化学兴趣小组采用下面的实验装置图制备纯净的氯气,根据相关知识填空:
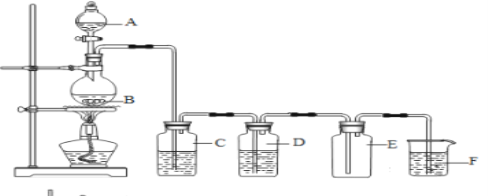
(1)A仪器的名称是_________________,B中发生的化学方程式为__________________________
(2)装置C中盛放的试剂是__________,装置F中的离子方程式为__________________________
(3)氯气溶于水制得氯水,请设计实验验证干燥的氯气无漂白性、新制的氯水具有酸性与漂白性(写出必要的实验步骤与实验现象)_________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨和硝酸都是重要的工业原料。
(1)标准状况下,将500 L氨气溶于水形成1 L氨水,则此氨水的物质的量浓度为__mol· L-1(保留三位有效数字)。工业上常用过量氨水吸收二氧化硫,该反应的化学方程式为__。
(2)氨氧化法是工业生产中合成硝酸的主要途径。合成的第一步是将氨和空气的混合气通过灼热的铂铑合金网,在合金网的催化下,氨被氧化成一氧化氮,该反应的化学方程式为__。
(3)下列反应中的氨与氨氧化法中的氨作用相同的是__。
A.2Na+2NH3=2NaNH2+H2↑ B.2NH3+3CuO=3Cu+N2+3H2O
C.4NH3+6NO=5N2+6H2O D.HNO3+NH3=NH4NO3
(4)工业中的尾气(假设只有NO和NO2)用烧碱进行吸收,反应的离子方程式为2NO2+2OH﹣=NO2﹣+NO3﹣+H2O和NO+NO2+2OH﹣=__+H2O(配平该方程式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是四种常见有机物的比例模型,请回答下列问题:

(1)向丙中加入溴水,振荡静置后,观察到溶液分层,上层为_______色。
(2)甲的同系物的通式为CnH2n+2,当n=5时,写出含有3个甲基的有机物的结构简式_____。
下图是用乙制备D的基本反应过程

(3)A中官能团为__________。
(4)反应①的反应类型是__________。
(5)写出反应④的化学方程式_______。
(6)现有138gA和90gC发生反应得到80gD。试计算该反应的产率为______(用百分数表示,保留一位小数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com