
 ;E的离子结构示意图
;E的离子结构示意图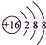 .
.分析 A、B、C、D、E都是前20号元素中的常见元素,且原子序数递增.A原子没有中子,则A为H元素;C元素是地壳中含量最高的元素,则C为O元素;B原子次外层电子数与最外层电子数之差等于电子层数,原子序数小于氧元素,B有2个电子层,最外层电子数为4,故B为碳元素;4.6g D单质与足量盐酸作用可产生2.24LH2(标准状态下),D为金属,令D的摩尔质量为xg/mol,化合价为y,由电子转移守恒:$\frac{4.6g}{xg/mol}$×y=$\frac{2.24L}{22.4L/mol}$×2,即23y=x,为前20号元素中的常见元素,故y=1,x=23,则D为Na元素;E的二价阴离子的核外电子排布与Ar的核外电子排布相同,则E为S元素.
解答 解:A、B、C、D、E都是前20号元素中的常见元素,且原子序数递增.A原子没有中子,则A为H元素;C元素是地壳中含量最高的元素,则C为O元素;B原子次外层电子数与最外层电子数之差等于电子层数,原子序数小于氧元素,B有2个电子层,最外层电子数为4,故B为碳元素;4.6g D单质与足量盐酸作用可产生2.24LH2(标准状态下),D为金属,令D的摩尔质量为xg/mol,化合价为y,由电子转移守恒:$\frac{4.6g}{xg/mol}$×y=$\frac{2.24L}{22.4L/mol}$×2,即23y=x,为前20号元素中的常见元素,故y=1,x=23,则D为Na元素;E的二价阴离子的核外电子排布与Ar的核外电子排布相同,则E为S元素.
(1)由上述分析可知,A 为H,B 为C,D为Na,
故答案为:H; C; Na;
(2)C为O元素,氧原子获得2个电子形成氧离子,电子式为 .E为S元素,硫离子结构示意图为
.E为S元素,硫离子结构示意图为 ,
,
故答案为: ;
; ;
;
(3)由A、B、C、D形成的化合物M为NaHCO3等,NaHCO3的电离方程式:NaHCO3=Na++HCO3-,
故答案为:NaHCO3=Na++HCO3-.
点评 本题考查结构性质位置关系应用、常用化学用语等,难度不大,推断元素是解题的关键,注意计算讨论确定D为钠.


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:选择题
| A. | 硅酸钠可用于制备木材防火剂 | B. | 硅单质广泛用于光纤通讯 | ||
| C. | 硅酸可由二氧化硅与水反应制得 | D. | 水晶项链是硅酸盐制品 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
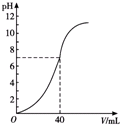 用1mol•L-1NaOH溶液中和某浓度的硫酸溶液时,其pH和所加NaOH溶液的体积关系如图所示,原硫酸溶液的物质的量浓度和反应后溶液的总体积(体积变化忽略不计)分别是( )
用1mol•L-1NaOH溶液中和某浓度的硫酸溶液时,其pH和所加NaOH溶液的体积关系如图所示,原硫酸溶液的物质的量浓度和反应后溶液的总体积(体积变化忽略不计)分别是( )| A. | 0.5 mol•L-1 100 mL | B. | 0.5 mol•L-180 mL | ||
| C. | 1 mol•L-160 mL | D. | 1 mol•L-180 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含H2SO40.2mol的浓硫酸与足量的Cu反应可产生SO2分子数为0.1NA | |
| B. | 足量Fe与1 mol氯气反应,转移的电子数为3NA | |
| C. | 标准状况下,22.4LSO3含有分子的数目为NA个 | |
| D. | 1molNa2O2所含离子总数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 X、Y、Z、W、R.均为前四周期元素且原子序数依次增大,X的基态原子核外有7种不同运动状态的电子,Y原子最外层有2对成对电子,Z的原子序数为Y的原子序数的2倍,W3+的基态离子3d轨道为半充满状态,R的氢氧化物悬浊液可用于检验葡萄糖的存在.
X、Y、Z、W、R.均为前四周期元素且原子序数依次增大,X的基态原子核外有7种不同运动状态的电子,Y原子最外层有2对成对电子,Z的原子序数为Y的原子序数的2倍,W3+的基态离子3d轨道为半充满状态,R的氢氧化物悬浊液可用于检验葡萄糖的存在.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com