
【题目】下图是无机物A~F在一定条件下的转化关系(部分产物及反应条件未标出)。其中A为气体;A~F都含有相同的元素。
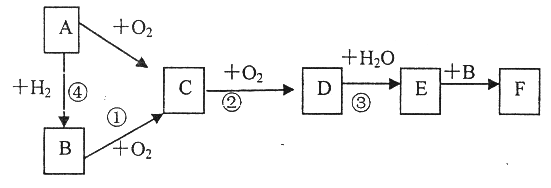
试回答下列问题:
(1)写出下列物质的化学式:C_________、F_________
(2)写出下列反应的化学方程式:
①____________________________________。
③___________________________,该反应氧化剂与还原剂的物质的量之比为_________。
(3)铜与E的浓溶液反应的离子方程式为_________。
(4)25.6g铜与含有1.4 mol E的浓溶液恰好完全反应,最终得到气体的体积为(标准状况下)_________L。
【答案】 NO NH4NO3 4NH3+5O2![]() 4NO+6H2O 2NO2+H2O=2HNO3+NO 1:2 Cu+4H++2NO3-=Cu2++2H2O+2NO2↑ 13.44L
4NO+6H2O 2NO2+H2O=2HNO3+NO 1:2 Cu+4H++2NO3-=Cu2++2H2O+2NO2↑ 13.44L
【解析】气体A能够与氢气反应生成B,也能够与氧气反应生成C,C能够继续氧化生成D,D能够与水反应生成E,则E为酸,E能够与B反应,则A为氮气,B为氨气,C为一氧化氮,D为二氧化氮,E为硝酸,F为硝酸铵。
(1)根据上述分析,C为一氧化氮,F为硝酸铵,故答案为:NO;NH4NO3;
(2)反应①为氨气的催化氧化,反应的化学方程式为4NH3+5O2![]() 4NO+6H2O,故答案为:4NH3+5O2
4NO+6H2O,故答案为:4NH3+5O2![]() 4NO+6H2O;
4NO+6H2O;
反应③为二氧化氮与水生成硝酸的反应,反应的化学方程式为2NO2+H2O=2HNO3+NO,该反应氧化剂与还原剂都是二氧化氮,物质的量之比为1:2,故答案为:2NO2+H2O=2HNO3+NO; 1:2;
(3)铜与浓硝酸反应生成硝酸铜、二氧化氮和水,反应的离子方程式为Cu+4H++2NO3-=Cu2++2H2O+2NO2↑,故答案为:Cu+4H++2NO3-=Cu2++2H2O+2NO2↑;
(4)25.6g铜的物质的量为![]() =0.4mol,与含有1.4 mol 的硝酸的浓溶液恰好完全反应,反应中转移电子0.8mol,生成0.4mol硝酸铜,同时生成1.4mol-0.4mol×2=0.6mol的一氧化氮和二氧化氮的混合气体,在标准状况下的体积为0.6mol×22.4L/mol=13.44L,故答案为:13.44。
=0.4mol,与含有1.4 mol 的硝酸的浓溶液恰好完全反应,反应中转移电子0.8mol,生成0.4mol硝酸铜,同时生成1.4mol-0.4mol×2=0.6mol的一氧化氮和二氧化氮的混合气体,在标准状况下的体积为0.6mol×22.4L/mol=13.44L,故答案为:13.44。
点晴:本题考查无机物的推断。注意把握推断的突破口,通常从物质的颜色,性质和反应现象为突破口进行推断。本题的突破口为A能够连续氧化,则E为酸,B为氢化物,二者能够反应。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】如图所示X、Y、Z、W均为短周期元素,它们在周期表中的相对位置如图所示。若X原子的最外层电子数是内层电子数的2倍,下列说法中正确的是 ( )
![]()
A. X 、Y对应的氧化物都是酸性氧化物
B. X的氧化物不能与Mg发生化学反应
C. Z比Y更容易与氢气化合
D. W与X形成的化合物中化学键类型为共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是

A. 电池工作时,CO32-向电极B移动
B. 电极A上H2参与的电极反应为:H2+2OH--2e-=2H2O
C. 电极B上发生的电极反应为:O2+2CO2+4e-=2CO32-
D. 反应CH4+H2O![]() 3H2+CO,每消耗1mol CH4转移12mol电子
3H2+CO,每消耗1mol CH4转移12mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期主族元素X、Y、Z、W的原子序数依次增大。化合物甲由X、Y、Z三种元素组成,25℃时,0.01mol·L-1甲溶液中的![]() ;Z与W同周期,且W的最高正价与最低负价的代数和为4。下列说法中正确的是
;Z与W同周期,且W的最高正价与最低负价的代数和为4。下列说法中正确的是
A. 原子半径:X<Y<Z<W
B. 最简单氢化物的稳定性:Y>W
C. Z分别与Y、W组成的化合物中化学键类型均相同
D. 粘有W的单质的试管可用酒精洗涤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】升高温度时,化学反应速率加快,主要是由于
A. 分子运动速率加快,使反应物分子间的碰撞机会增多
B. 反应物分子的能量增加,活化分子百分数增大,有效碰撞次数增多,化学反应速率加快
C. 该化学反应的过程是放热的
D. 该化学反应的过程是吸热的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为元素周期表的一部分,参照元素①~⑩在表中的位置,请用化学用语作答:

(1)⑤、⑥、⑦ 的离子半径由大到小的顺序为_________。(填离子符号)
(2)⑧、⑨、⑩的最高价含氧酸的酸性由强到弱为_______。(用化学式表示)
(3)写出⑥在空气中加热生成的产物的电子式:_______。与⑧同族的砷(As)的原子结构示意图为_____________。
(4)⑦和⑩形成的化合物的物理性质非常特殊,其的熔点为190℃(2.02×105Pa),但在180℃就开始升华。据此判断,该是_______(填“共价化合物”或“离子化合物”) , 可以证明你的判断正确的实验依据是________________。
(5)表中所列元素的原子间反应最容易形成离子键的是_________(填元素符号)。⑧与⑩元素形成的常见分子中所有原子______(填“是”或“不是”)都满足最外层为8电子结构。
(6)己知某些不同族元素的性质也有一定的相似性,如元素②与元素⑦的氢氧化物有相似的性质。写出元素②的氢氧化物与NaOH溶液反应的离子方程式:______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com