
下图中A—H为中学化学常用仪器,请根据要求回答:
(1)上述仪器中,D的瓶体上标有(图中未画出)刻度线、温度、 ▲ 。
(2)分离乙醇和水的混合物,需用到上述仪器中的▲ (填仪器的编号字母)。
(3)下列关于仪器B的使用方法中,正确的是 ▲ 。
A.使用前应先检查是否漏液
B.可用于分离乙醇和水的混合物
C.用于分液时应先打开分液漏斗上面的塞子
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

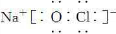
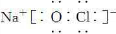
查看答案和解析>>
科目:高中化学 来源:湖南师大附中2006-2007学年度上学期高三月考试卷(四)、化学试题 题型:022
| |||||||||||||||||||
查看答案和解析>>
科目:高中化学 来源: 题型:

请回答下列问题:
(1)若反应①是在加热条件下进行的,则A是(填化学式)__________;若反应①是在常温条件下进行的,则A是____________________(填化学式);若在上述两种条件下得到等量的C单质,反应中转移的电子数之比为____________________.
(2)H用途广泛如用作催化剂、印刷电路腐蚀剂和外伤止血剂及净水等.若将Cu棒与C棒用导线连接并插入H溶液中,可形成原电池,其中正极电极反应方程式为: ____________________.总离子方程式为:____________________.F与B反应的离子方程式为: ____________________.
(3)经测定A为二元弱酸,其酸性比碳酸弱,写出A在水溶液中的电离方程式: ____________________.A与氨气反应生成的酸式盐的化学式为:____________________.若将适量MnO2加入酸化后的A溶液中,MnO2溶解产生Mn2+,该反应的离子方程式为: ____________________.
查看答案和解析>>
科目:高中化学 来源:2013-2014学年辽宁省高三上学期12月月考化学试卷(解析版) 题型:填空题
下图是中学化学某些物质之间在一定条件下的相互转化关系,已知A是一种常见的液态化合物, C、D、G、H、K是单质,其它为化合物,G、K是普通钢中的两种重要元素,其中K含量少,E、F对应溶液的酸碱性相反,F的焰色反应为黄色,请按要求作答:

(1)写出化合物J的电子式:_______________。
(2)G3+比G2+的稳定性的原因 ,组成D、H、K三种元素的第一电离能由大到小的顺序为 (写元素符号)。A分子中心原子的杂化方式为 ,A可与Cu2+形成天蓝色的物质,画出该离子的结构示意图 ,写出一种与化合物I 为等电子体关系的阴离子
(3)B与足量稀硝酸反应,当参加反应的硝酸为4mol,转移电子的物质的量为 _________mol(保留2位有效数字)。
(4)已知在200℃,101Kpa下,0.12g单质K与A完全反应生成C与I,吸收了1316 J的能量,写出此反应的热化学方程式:_________________________。
(5)①以Pt为电极,由I、D以及F的溶液组成原电池,则负极的电极反应为:___________。
②若用此电池电解300mL 5mol/L的氯化钠溶液一段时间,两极均收集到标准状况下3.36L气体,此时溶液的pH为_________(假设电解前后溶液体积不变化)。
③若往该电解后所得溶液中通入二氧化碳气体4.48L(标准状况),此时溶液中所有离子浓度的关系由大到小的顺序为:_______________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com