
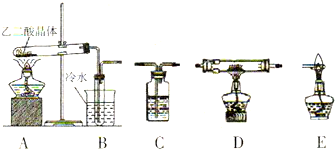
| 装置编号 | 装置中所加物质 | 装置作用 |
| B | -------- | |
| C | ||
| C | 氢氧化钠浓溶液 | |
| C | ||
| D | ||
| E | -------- |
| ||
| ||
| 装置编号 | 装置中所加物质 | 装置作用 |
| B | ------ | 检验H2O(g);冷却凝固乙二酸蒸汽,防止其进入澄清石灰水影响CO2的检验 |
| C | 澄清石灰水 | 检验CO2 |
| C | 吸收多余的CO2 | |
| C | 浓硫酸 | 吸收水蒸气 |
| D | CuO或Fe2O3 | 检验CO |
| E | -------- | 处理CO尾气,防止污染空气 |


 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源: 题型:
 如图是研究铜与浓硫酸的反应装置:
如图是研究铜与浓硫酸的反应装置:| 资料1 |
| ||||||||||||
| 资料2 | X射线晶体分析表明,铜与浓硫酸反应生成的黑色物质为Cu2S、CuS、Cu7S4中的一种或几种. |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、若图I为合成氨,则其中N2、H2可循环使用 |
| B、若图I为合成SO3,则其中SO2、O2可循环使用 |
| C、若图Ⅱ为电解熔融MgCl2得到镁,则其中HCl可循环使用 |
| D、若图Ⅲ为氨氧化法制硝酸,则其中NO2可循环使用 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硅原子和钠原子 |
| B、硼原子和氦原子 |
| C、氯原子和碳原子 |
| D、碳原子和铝原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某研究性学习小组利用以下材料来探究NH3的还原性,部分实验装置如下图.材料1:NH3是强还原剂,能将某些金属氧化物还原为金属单质或低价态的氧化物.如:2NH3+3CuO
某研究性学习小组利用以下材料来探究NH3的还原性,部分实验装置如下图.材料1:NH3是强还原剂,能将某些金属氧化物还原为金属单质或低价态的氧化物.如:2NH3+3CuO
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:3 | B、2:3 |
| C、3:1 | D、3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CO、H2的浓度都比原平衡时的要小 |
| B、CO、H2的浓度都比原平衡时的要大 |
| C、H2、H2O(g)的浓度都比原平衡时的要大 |
| D、CO、H2O(g)的浓度都比原平衡时的要大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com