
| A、在淀粉溶液中加稀硫酸充分反应后,再加入银氨溶液,可检验淀粉的水解产物 |
| B、用溴水可以鉴别苯、乙醇、四氯化碳三种液体 |
| C、除去苯中的苯酚,可加入NaOH溶液后再分液 |
| D、将氯乙烷与NaOH的乙醇溶液共热,将产生的气体直接通入酸性高锰酸钾溶液中,溶液褪色,证明氯乙烷发生了消去反应. |


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
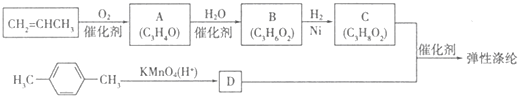
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
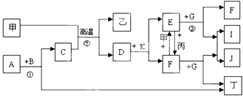 下列各物质是中学化学中常见的物质,甲为常见金属单质,乙、丙、丁是非金属单质,其它为化合物,B、D分别为黑色粉末和黑色晶体,G为淡黄色固体,J为生活中常见的调味品,I为红褐色固体,①是实验室制取丁的反应之一,F为棕黄色溶液.各物质间的转化如如图所示,回答下列各问题(部分生成物未列出):
下列各物质是中学化学中常见的物质,甲为常见金属单质,乙、丙、丁是非金属单质,其它为化合物,B、D分别为黑色粉末和黑色晶体,G为淡黄色固体,J为生活中常见的调味品,I为红褐色固体,①是实验室制取丁的反应之一,F为棕黄色溶液.各物质间的转化如如图所示,回答下列各问题(部分生成物未列出):查看答案和解析>>
科目:高中化学 来源: 题型:
| A、配制溶液时,将量筒中液体倒入烧杯后,应将量筒洗涤,将洗涤液也倒入烧杯 |
| B、用干燥的pH试纸分别测1mol?L-1的NaOH溶液和1mol?L-1的H2SO4的pH |
| C、稀释浓硫酸时,把浓硫酸慢慢倒入盛有水的烧杯中并不断搅拌 |
| D、向酒精灯加酒精时,应将试剂瓶中的酒精直接倒入酒精灯中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
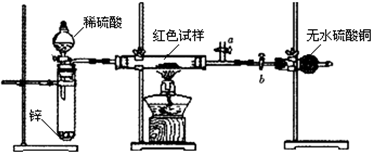 已知:①Cu2O与Cu均为红色固体,Cu2O酸性条件下易发生歧化反应.
已知:①Cu2O与Cu均为红色固体,Cu2O酸性条件下易发生歧化反应.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.2mol/L CH3COONa溶液和0.1mol/L HCl溶液等体积混合之后:c(Na+)=2c(Cl-)=c(CH3COO-)+c(CH3COOH)=0.2mol/L |
| B、0.1mol/LNa2CO3溶液:c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-) |
| C、0.1mol/L的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-) |
| D、25℃时,向10mL pH=4的盐酸中,加入pH=10的一元碱BOH溶液至pH刚好等于7,则反应后的溶液总体积:V总≤20mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、a1、a2均减小 |
| B、a1、a2均增大 |
| C、a1增大,a2减小 |
| D、a1减小,a2增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com