
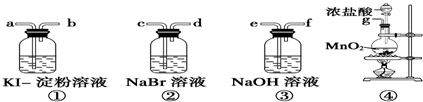
分析 (1)比较卤素单质的氧化性强弱,首先制备氯气,再把氯气通过NaBr溶液和KI-淀粉溶液,最后通过尾气处理装置;
(2)装置④烧瓶中二氧化锰与浓盐酸在加热条件下生成氯化锰、氯气和水;
(3)装置①中氯气与碘化钾反应生成单质碘;氢氧化钠溶液用于吸收多余的氯气;
(4)装置②中氯气与溴化钠溶液反应生成氯化钠和单质溴;
(5)在碘溶液中加NaOH溶液会生成NaI和NaIO.
解答 解:(1)比较卤素单质的氧化性强弱,装置④烧瓶中二氧化锰与浓盐酸反应生成氯气,再把氯气通过NaBr溶液,与溴化钠反应生成氯化钠和单质溴,氯气再通过KI-淀粉溶液生成单质碘,最后通过盛有氢氧化钠溶液的装置吸收多余的氯气,所以各仪器的正确连接顺序为g-c-d-a-b-e;
故答案为:c、d、a、b、e;
(2)装置④烧瓶中二氧化锰与浓盐酸在加热条件下生成氯化锰、氯气和水,其反应方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(3)装置①中氯气与碘化钾反应生成单质碘,碘使淀粉溶液变蓝色;氯气属于有毒气体会污染环境,所以要用氢氧化钠溶液用于吸收多余的氯气;
故答案为:溶液变蓝色;吸收剩余Cl2;
(4)装置②中氯气与溴化钠溶液反应生成氯化钠和单质溴,其反应的离子方程式为:Cl2+2Br-═Br2+2Cl-;
故答案为:Cl2+2Br-═Br2+2Cl-;
(5)反应后的①溶液为单质碘的溶液,在碘溶液中加NaOH溶液会生成NaI和NaIO,其反应方程式为:I2+2NaOH═NaI+NaIO+H2O,所以溶液蓝色会褪去;
故答案为:蓝色褪去;I2+2NaOH═NaI+NaIO+H2O.
点评 本题考查实验方案的设计,题目难度中等,熟悉氯气的制取原理及物质的性质是解答本题的关键,注意发生的氧化还原反应为解答的难点,试题培养了学生的分析能力及化学实验能力.


科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | C | N | O | |||||
| 3 | Na | Mg | Si | S | Cl | Ar | ||
| 4 | Ca |
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸镁 | B. | 硫酸钡 | C. | 氢氧化镁 | D. | 碳酸钡 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
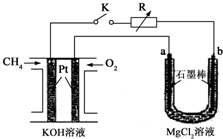 新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2,电解质为KOH溶液.某研究小组将甲烷燃料电池作为电源进行氯化镁溶液电解实验,电解装置如图所示.请回答下列问题:
新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2,电解质为KOH溶液.某研究小组将甲烷燃料电池作为电源进行氯化镁溶液电解实验,电解装置如图所示.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 现象 | 解释 |
| A | Cl2在H2中点燃,瓶口有白雾 | 生成HCl极易溶于水 |
| B | 饱和Na2CO3溶液中通入CO2析出白色晶体 | 生成NaHCO3溶解度小析出 |
| C | 常温下将铝片放入浓硝酸中无明显变化 | Al和浓硝酸不反应 |
| D | SO2通入溴水,溴水褪色 | SO2具有还原性. |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com