
【题目】按要求填空:
(1)在室温下,等体积、等浓度的氢氧化钠与醋酸混合后溶液呈__性,溶液中c(Na+)__c(CH3COO-)(填“>”“=”或“<”);pH=13的氢氧化钠与pH=1的醋酸等体积混合后溶液呈__性,溶液中c(Na+)___c(CH3COO-)(填“>”“=”或“<”);
(2)下列溶液,①0.1mol/L HCl溶液②0.1mol/L H2SO4溶液③0.1mol/L NaOH溶液④0.1mol/L CH3COOH溶液,按pH由小到大顺序为______________。
(3)CuSO4的水溶液呈酸性的原因是(用离子方程式表示):____;实验室在配制CuSO4的溶液时,常将CuSO4固体先溶于较浓的硫酸中,然后再用蒸馏水稀释到所需的浓度,以___(填“促进”、“抑制”)其水解。
(4)已知:难溶电解质Cu(OH)2在常温下的KSP=2×10-20,则常温下:某CuSO4溶液中c(Cu2+)=0.02molL-1,如要生成Cu(OH)2沉淀,应调整溶液的pH最小为____。
【答案】碱 > 酸 < ②①④③ Cu2++2H2O![]() Cu(OH)2+2H+ 抑制 5
Cu(OH)2+2H+ 抑制 5
【解析】
(1)根据反应后溶液的酸碱性及电荷守恒判断;
(2)强酸强碱完全电离,弱酸弱碱部分电离,据PH=-lg(H+)进行计算;
(3)CuSO4是强酸弱碱盐,铜离子水解导致溶液呈酸性,加酸可抑制其水解;
(4)要产生沉淀应c(Cu2+)c2(OH-)![]() Ksp。
Ksp。
(1)等体积、等浓度的氢氧化钠与醋酸混合,恰好反应生成醋酸钠溶液,溶液中的醋酸根离子水解溶液显碱性,据电荷守恒c(H+)+c(Na+)=c(CH3COO-)+c(OH-)知钠离子浓度大于醋酸根离子,c(Na+)>c(CH3COO);pH=13的氢氧化钠与pH=1的醋酸溶液中氢氧根离子浓度和氢离子浓度相同,等体积混合后醋酸又电离出氢离子,溶液显酸性,据电荷守恒c(H+)+c(Na+)=c(CH3COO-)+c(OH-)知醋酸根离子浓度大于钠离子浓度,c(Na+)<c(CH3COO),
故答案为:碱;>;酸;<;
(2)①0.1mol/L HCl中c(H+)=0.1mol/L,pH=1;
②0.1mol/L H2SO4溶液中c(H+)=0.2mol/L,pH=-lg(H+)<1;
③0.1mol/L NaOH溶液中c(OH-)=0.1mol/L,c(H+)=10-13mol/L,PH=13;
④0.1mol/L CH3COOH由于CH3COOH是弱酸,所以溶液中c(H+)<0.1mol/L,PH>1,
所以按pH由小到大顺序为②①④③,
故答案为:②①④③
(3)CuSO4是强酸弱碱盐,铜离子水解方程式为Cu2++2H2OCu(OH)2+2H+,水解后溶液中c(H+)>c(OH),所以溶液呈酸性,即常温下pH<7;为防止CuSO4水解,所以配制CuSO4溶液时将CuSO4先溶于较浓的硫酸中,抑制其水解,然后稀释,
故答案为:酸;抑制;
(4)某CuSO4溶液里c(Cu2+)=0.02mol/L,如果生成Cu(OH)2沉淀,则应有c(Cu2+)c2(OH-)![]() 2×1020由于c(Cu2+) =0.02mol/L,c(OH-)≥10-9mol/L,则c(H+)≤1×1014/10-9mol/L=10-5mol/L,所以pH≥-lg(10-5)=5,
2×1020由于c(Cu2+) =0.02mol/L,c(OH-)≥10-9mol/L,则c(H+)≤1×1014/10-9mol/L=10-5mol/L,所以pH≥-lg(10-5)=5,
故答案为:5。


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
【题目】已知:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=-41kJ·mol-1。相同温度下,在容积相同的两个恒温密闭容器中,加入一定量的反应物发生反应。相关数据如下:
CO2(g)+H2(g) ΔH=-41kJ·mol-1。相同温度下,在容积相同的两个恒温密闭容器中,加入一定量的反应物发生反应。相关数据如下:
容器编号 | 起始时各物质物质的量/mol | 达平衡过程体系能量的变化 | |||
CO | H2O | CO2 | H2 | ||
① | 1 | 4 | 0 | 0 | 放出热量:32.8kJ |
② | 0 | 0 | 1 | 4 | 热量变化:QkJ |
下列说法中,不正确的是( )
A.容器①中反应达平衡时,CO的转化率为80%
B.容器①中CO的转化率等于容器②中CO2的转化率
C.平衡时,两容器中CO2的浓度相等
D.容器①时CO的反应速率等于H2O的反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列8种物质:①Na2CO3 ②NaHCO3 ③NH4Cl ④酒精 ⑤CO2 ⑥Al ⑦食盐水 ⑧H2C2O4(草酸)
(1)上述物质中属于强电解质的是_________________(填序号),既能跟盐酸反应又能跟NaOH溶液反应的是________________(填序号)。
(2)上述③的水溶液呈酸性的原因是(用离子方程式表示)_________________。
(3)请写出⑧使KMnO4酸性溶液褪色的离子方程式_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大气中的氮氧化物![]() 、
、![]() 、
、![]() 等的含量高低是衡量空气质量优劣的重要指标,对其研究和综合治理具有重要意义。
等的含量高低是衡量空气质量优劣的重要指标,对其研究和综合治理具有重要意义。
![]() 汽车发动机工作时会引发反应:
汽车发动机工作时会引发反应:![]() ,
,![]() ,其能量变化示意图如下:
,其能量变化示意图如下:
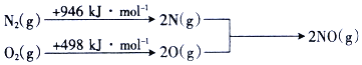
则NO中氮氧键的键能为______![]() 。
。
![]() 以碱液为电解质可实现如下转化:
以碱液为电解质可实现如下转化:![]()
![]()
![]() ,
,![]() 该反应在一定条件下能自发进行的原因是______,阴极反应式为______。
该反应在一定条件下能自发进行的原因是______,阴极反应式为______。
![]() 将
将![]() 和
和![]() 溶于水可得到相应的酸
溶于水可得到相应的酸![]() 时,两种酸的电离平衡常数如表:
时,两种酸的电离平衡常数如表:
|
| |
|
|
|
|
|
|
①![]() 的水解平衡常数为______。
的水解平衡常数为______。
②![]() 溶液和
溶液和![]() 溶液反应的离子方程式为______。
溶液反应的离子方程式为______。
![]() 汽车尾气处理催化装置中涉及的反应之一为:
汽车尾气处理催化装置中涉及的反应之一为:![]() ,
,![]() 研究表明,在使用等质量的催化剂时,增大催化剂比表面积可提高化学反应速率。为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某科研小组设计了以下三组实验:
研究表明,在使用等质量的催化剂时,增大催化剂比表面积可提高化学反应速率。为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某科研小组设计了以下三组实验:
实验 编号 |
| NO初始浓度 | CO初始浓度 | 催化剂比表面积 |
Ⅰ | 400 |
|
| 82 |
Ⅱ | 400 |
|
| 124 |
Ⅲ | 450 |
|
| 124 |
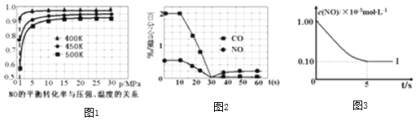
根据下列坐标图,计算前5s内用![]() 表示的反应速率为______;并在坐标图中画出上表实验Ⅱ、Ⅲ条件下,混合气体中NO浓度随时间变化的趋势
表示的反应速率为______;并在坐标图中画出上表实验Ⅱ、Ⅲ条件下,混合气体中NO浓度随时间变化的趋势![]() 标明各条曲线的实验编号
标明各条曲线的实验编号![]() 。______
。______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t℃时,Ag2CrO4(橘红色)在水溶液中的沉淀溶解平衡曲线如图所示.又知AgCl的Ksp=1.8×10-10。下列说法不正确的是( )
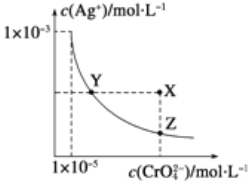
A. t℃时,Y点和Z点时Ag2CrO4的Ksp相等
B. 饱和Ag2CrO4溶液中加入K2CrO4不能使溶液由Y点变为X点
C. t℃时,Ag2CrO4的Ksp为1×10-8
D. t℃时,将0.01mol·L-1 AgNO3溶液滴入20mL0.01mol·L-1 KCl和0.01mol·L-1 K2CrO4的混合溶液中,Cl-先沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用0.10 mol·L-1标准NaOH溶液滴定某浓度的盐酸。记录数据如下:
实验 序号 | 待测液 体积/mL | 所消耗NaOH标准液的体积/mL | |
滴定前读数/mL | 滴定后读数/mL | ||
1 | 20.00 | 0.50 | 20.54 |
2 | 20.00 | 6.00 | 26.00 |
3 | 20.00 | 1.40 | 21.36 |

(1)滴定时选用酚酞试液作指示剂,如何判断滴定达到终点____________。
(2)滴定过程中,眼睛应注视_____________________;
(3)盐酸的物质的量浓度为___________。
(4)碱式滴定管尖嘴部分有气泡,滴定后消失,对测定结果的影响是__________(填“偏高”“偏低”或“无影响”)。
(5)某同学用已知准确浓度的高锰酸钾溶液滴定溶液中Fe2+的浓度,高锰酸钾溶液应盛放在________(填“甲”或“乙”)中,该反应的离子方程式为_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,下列各组离子在指定溶液中能大量共存的是( )
A.0.1 mol·L-1 NaHCO3溶液:Na+、Ba2+、NO3-、OH-
B.0.1 mol·L-1NaAlO2溶液:K+、OH-、Cl-、NO3-
C.常温下,![]() =1.0×1012的溶液:Fe2+、Mg2+、NO3-、Cl-
=1.0×1012的溶液:Fe2+、Mg2+、NO3-、Cl-
D.能使淀粉碘化钾试纸显蓝色的溶液:K+、SO32-、S2-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同温度下,体积为2L的两个恒容容器中发生:![]() 均为气态物质
均为气态物质![]() 有下表所示实验数据:
有下表所示实验数据:
容器编号 | 起始时各物质的物质的量 | 达到平衡时体系能量的变化 | ||
|
|
| ||
① | 1 | 3 | 0 |
|
② | 0 | 0 | 2 |
|
③ |
|
|
|
|
下列有关说法正确的是
A.![]()
B.②中![]() 的转化率大于③中
的转化率大于③中![]() 的转化率
的转化率
C.容器①与③分别达到平衡时,平衡常数相同,且![]()
D.将容器①的反应条件换为恒温恒压中进行![]() 投料量不变
投料量不变![]() ,达到平衡时,气体平均摩尔质量较恒温恒容时减小了
,达到平衡时,气体平均摩尔质量较恒温恒容时减小了
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:

(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
①电解池中X极上的电极反应是______________。在X极附近观察到的现象是______________________________。
②Y电极上的电极反应式是______________。检验该电极反应产物的方法是______________。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
①X电极的材料是___________________,电极反应式是______________。
②Y电极的材料是___________________,电极反应式是______________。
(说明:杂质发生的电极反应不必写出)
③假若电路中有0.04摩尔电子通过时,阴极增重________克。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com