
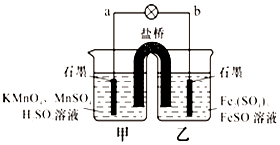
 某合作学习小组的同学利用下列氧化还原反应设计原电池:2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O盐桥中装有饱和K2SO4溶液,下列叙述中正确的是( )
某合作学习小组的同学利用下列氧化还原反应设计原电池:2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O盐桥中装有饱和K2SO4溶液,下列叙述中正确的是( )| A. | 外电路的电流方向是从a到b | |
| B. | 甲烧杯中溶液的pH逐渐减小 | |
| C. | 电池工作时,盐桥中的SO42-移向甲烧杯 | |
| D. | 乙烧杯中发生还原反应 |
分析 由2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O可知,Mn元素的化合价降低,得到电子,Fe元素的化合价升高,失去电子,则b为负极,a为正极,结合原电池中负极发生氧化反应,电流从正极流向负极,阴离子向负极移动来解答.
解答 解:A.由上述分析可知,a为正极,b为负极,则电流从a到b,故A正确;
B.甲烧杯中发生反应为:MnO4-+8H++5e-═Mn2++4H2O,氢离子浓度减小,导致溶液的pH增大,故B错误;
C.阴离子向负极移动,则盐桥中的SO42-移向乙烧杯中,故C错误;
D.甲烧杯中(a电极)发生还原反应,Mn元素的化合价降低,电极反应为MnO4-+8H++5e-═Mn2++4H2O,b电极亚铁离子失去电子发生氧化反应,故D错误;
故选A.
点评 本题考查原电池的工作原理及常见的化学电源,题目难度中等,明确氧化还原反应中元素的化合价变化及原电池工作原理是解答本题的关键,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:选择题
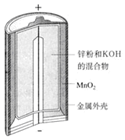 | 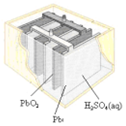 | 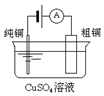 | 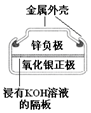 |
| 图Ⅰ碱性锌锰电池 | 图Ⅱ铅蓄电池 | 图Ⅲ电解精炼铜 | 图Ⅳ银锌纽扣电池 |
| A. | 图Ⅰ所示电池中,锌为负极,MnO2的作用是催化剂 | |
| B. | 图II所示电池二氧化铅为正极,放电过程中硫酸浓度不变 | |
| C. | 图III所示装置工作过程中,电解质溶液中Cu2+浓度始终不变 | |
| D. | 图IV所示电池工作过程中,Ag2O是氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
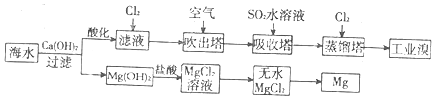
| A. | 若提取1 mol Br2,至少需要标准状况下44.8 L的Cl2 | |
| B. | 工业上常利用电解熔融MgCl2冶炼金属镁 | |
| C. | 富集溴元素过程中,空气吹出法利用了溴易挥发的性质 | |
| D. | 工业溴中含少量Cl2,可用氢氧化钠溶液除去 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 消耗0.8molNaClO3时,转移的电子数为0.8NA | |
| B. | H2O不是氧化产物,也不是还原产物,CO2是还原产物,ClO2是氧化产物 | |
| C. | 氧化剂和还原剂的物质的量之比为4:1 | |
| D. | 每生成1molCO2需转移24mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 现有下列几种有机物:
现有下列几种有机物: .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 此时,v (A):v (B):v (C):v (D)=4:3:2:1 | |
| B. | 该反应体系中气体的平均相对分子质量不变不可作为平衡标志 | |
| C. | 充入N2使压强增大可加快反应速率 | |
| D. | C的平均反应速率为:0.15mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl-的数目为 NA | |
| B. | 0.2 mol Fe与足量水蒸气反应,生成的H2分子数目为0.3 NA | |
| C. | 标准状况下,22.4LH2O含有的分子数为NA | |
| D. | 一定条件下2.3gNa与一定量氧气反应生成Na2O和Na2O2的混合物,转移的电子数一定为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
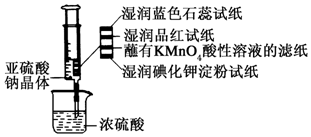 如图所示,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准).则下列有关说法正确的是( )
如图所示,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准).则下列有关说法正确的是( )| A. | 湿润的蓝色石蕊试纸只变红不褪色 | |
| B. | 湿润的品红试纸蘸有KMnO4酸性溶液的滤纸均褪色证明了SO2的漂白性 | |
| C. | 湿润的碘化钾淀粉试纸未变蓝说明SO2不能将I-还原为I2 | |
| D. | 实验后,可把注射器中的物质推入NaOH溶液,以减少环境污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com