
| A. | 已知2C(s)+O2(g)═2CO(g)△H=-221kJ/mol,则C的燃烧热为110.5kJ/mol | |
| B. | 已知C(石墨,s)=C(金刚石,s)△H>0,则金刚石比石墨稳定 | |
| C. | 含20.0gNaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则表示该反应中和热的热化学方程式为NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.4kJ/mol | |
| D. | 已知:C(s)+O2(g)=CO2(g)△H1 C(s)+$\frac{1}{2}$O2(g)=CO (g)△H2,则△H1>△H2 |
分析 A.燃烧热是指1mol纯净物完全燃烧生成稳定的氧化物放出的热量,表示燃烧热的热化学方程式中可燃物为1mol,产物为稳定氧化物以此解答;
B、物质能量越高越活泼分析;
C、从中和热的定义来判断,中和热的热化学方程式必须让生成的水为1mol;
D、比较反应热的大小时要带着正负号比较.
解答 解:A.碳的燃烧热是指1mol碳完全燃烧生成的稳定的氧化物CO2放出的热量,从2C(s)+O2(g)=2CO(g)△H=-221kJ/mol可知1mol碳燃烧生成CO放出110.5 kJ,故△H=-110.5 kJ/mol不是碳的燃烧热,故A错误;
B、已知C(石墨,s)=C(金刚石,s)△H>0,反应是吸热反应,金刚石能量高于石墨,则金刚石比石墨活泼,故B错误;
C、在稀溶液中,酸跟碱发生中和反应生成1 mol水时的反应热叫做中和热中和热.20.0gNaOH的物质的量n=$\frac{m}{M}$=$\frac{20g}{40g/mol}$=0.5nol,与稀盐酸完全中和生成0.5mol水,此时放出热量28.7kJ,故当生成1mol水时放热57.4KJ,故该反应中和热的热化学方程式为:NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.4kJ/mol,故C正确;
D、反应 C(s)+O2(g)═CO2(g)△H1 ①和反应 C(s)+1/2 O2(g)═CO(g)△H2 ②均为放热反应,△H均小于0,由于反应①是碳的完全燃烧,②是碳的不完全燃烧,故①放出的热量多于②,则△H1<△H2.故D错误;
故选C.
点评 本题考查了燃烧热、中和热的概念分析理解,掌握热化学方程式的意义是解答本题的关键,题目较简单.


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
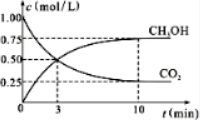
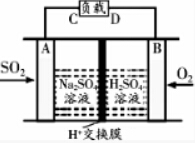
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知H2(g)+$\frac{1}{2}$O2(g)═H2O(g);△H=-241.8 kJ•mol-1,则氢气的燃烧热为241.8 kJ•mol-1 | |
| B. | 已知C(石墨,s)=C(金刚石,s);△H=+1.9 kJ•mol-1,则石墨比金刚石稳定 | |
| C. | 已知NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l);△H=-57.3 kJ•mol-1,则含1mol NaOH的稀溶液与1mol的稀醋酸完全中和,放出的热量也等于57.3kJ | |
| D. | 已知2C(s)+2O2(g)═2CO2(g))△H=a kJ•mol-1、2C(s)+O2(g)═2CO(g)△H=b kJ•mol-1,则a>b |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 427℃时该反应的平衡常数为9.4,则该反应的△H>0 | |
| B. | 800℃下,该反应的化学平衡常数为0.25 | |
| C. | 同温下,若继续向该平衡体系中通入1.0mol的H2O(g),则平衡时H2O(g)转化率为66.7% | |
| D. | 同温下,若继续向该平衡体系中通入1.0mol的CO(g),则平衡时H2O(g)物质的量分数为11.1% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、OH一、HCO3- Cu2+ | B. | NH4+、NO3-、OH-、K+ | ||
| C. | H+、K+、CO32-、SO42- | D. | Ba2+、OH一、C1-、Na+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com