
下列叙述错误的是
A.13C和14C属于同一种元素,它们互为同位素
B.1H和2H是不同的核素,它们的质子数相等
C.14C和14N的质量数相等,它们的中子数不等
D.6Li和7Li的电子数相等,中子数也相等
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:
能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应I: CO(g)+2H2(g)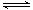 CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应II:CO2(g)+3H2(g)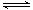 CH3OH(g)+ H2O(g) ΔH2
CH3OH(g)+ H2O(g) ΔH2
①上述反应符合“原子经济”原则的是 (填“I”或“Ⅱ”)。
②下表所列数据是反应I在不同温度下的化学平衡常数(K)。
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
由表中数据判断ΔH1 0 (填“>”、“=”或“<”)。
③某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)= 0.2 mol/L,则CO的转化率为 ,此时的温度为
(从上表中选择)。
(2)已知在常温常压下:
① 2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH =-1275.6 kJ/mol
② 2CO(g)+ O2(g)= 2CO2(g) ΔH =-566.0 kJ/mol
③ H2O(g)= H2O(l) ΔH =-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
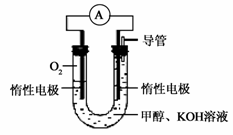 (3)某实验小组依据甲醇燃烧的反应原理,设计
(3)某实验小组依据甲醇燃烧的反应原理,设计
如右图所示的电池装置。
①该电池正极的电极反应为
。
②工作一段时间后,测得溶液的pH减小,
该电池总反应的离子方程式为
。
查看答案和解析>>
科目:高中化学 来源: 题型:
根据元素周期表和元素周期律分析下面的推断,其中错误的是( )
A.砹的氢化物不稳定 B.硒化氢比硫化氢稳定
C.氢氧化锶比氢氧化钙的碱性强 D.铍的原子失电子能力比镁弱
查看答案和解析>>
科目:高中化学 来源: 题型:
硫及其部分化合物的转化关系如图所示。
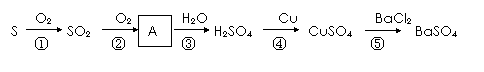 |
(1)硫单质俗称硫黄,通常状况下硫单质的颜色为 ;
(2)SO2可以使品红溶液褪色,说明SO2具有 (填“漂白性”或“氧化性”);
(3)化合物A的化学式为 ;
(4)反应⑤的离子方程式为 ;
(5)反应④中,当32g Cu完全反应时,被还原的H2SO4的物质的量为 mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、W、R均为第三周期主族元素,且原子序数依次增大。X、Y、W的最高价氧化物对应水化物两两之间都能发生反应,Z的单质具有半导体的特性,W原子的最外层电子数是其电子层数的2倍。下列说法错误的是
A.X与氧元素形成的化合物中可能含有共价键
B.第三周期元素的简单离子中Y离子的半径最小
C.Z、W的氧化物均为酸性氧化物
D.R元素含氧酸的酸性一定强于W
查看答案和解析>>
科目:高中化学 来源: 题型:
氨是最重要的氮肥,是产量最大的化工产品之一。课本里介绍的合成氨技术叫哈伯法,是德国人哈伯在1905年发明的,他因此获得了1918年诺贝尔化学奖。其合成原理为: N2(g)+3H2(g)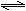 2NH3(g),其部分工艺流程如下:
2NH3(g),其部分工艺流程如下:
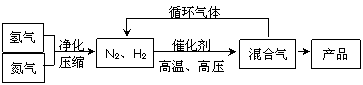

回答下列问题:
(1)已知299 K时,合成氨反应N2(g)+3H2(g)  2NH3(g) △H=-Q kJ/mol,将此温度下的1 mol N2 和3 mol H2 放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量为(忽略能量损失) ▲
2NH3(g) △H=-Q kJ/mol,将此温度下的1 mol N2 和3 mol H2 放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量为(忽略能量损失) ▲
A.一定大于Q kJ B.一定等于Q kJ C.一定小于Q kJ D. 不能确定
(2)已知反应:①N2(g) + O2(g) = 2NO(g) △H1=+180.5kJ/mol
②4NH3(g) + 5O2(g) = 4NO(g) + 6H2O(g) △H2=-905kJ/mol
③2H2(g) + O2(g) = 2H2O(g) △H3=-483.6kJ/mol
则N2(g)+3H2(g) 2NH3(g)的△H = ____________▲ ______________。
2NH3(g)的△H = ____________▲ ______________。
(3)可以用氯气来检验输送氨气的管道是否漏气,如果漏气则会有白烟(成份为氯化铵)生成。该反应的化学方程式为: ▲ 。
(4)一种“人工固氮”的新方法是在常温、常压、光照条件下,N2在催化剂表面与水发生反应生成NH3:N2+3H2O 2NH3+
2NH3+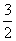 O2 进一步研究NH3生成量与温度的关系,部分实验数据见下表(反应时间3 h):请回答下列问题:
O2 进一步研究NH3生成量与温度的关系,部分实验数据见下表(反应时间3 h):请回答下列问题:
| T/℃ | 30 | 40 | 50 |
| 生成NH3量/(10-6 mol) | 4.8 | 5.9 | 6.0 |
①50℃时从开始到3 h内以O2物质的量变化表示的平均反应速率为_____▲ mol·h-1。
②该反应过程与能量关系可用如图表示,则反应的热化学方程式是__________________________▲________________________________________________。
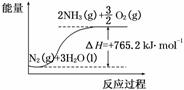
③工业合成氨的热化学方程式为N2(g)+3H2(g)  2NH3(g),在某压强恒定的密闭容器中加入2 mol N2和4 mol H2,达到平衡时,N2的转化率为50%,体积变为10 L。该条件下的平衡常数为___▲____;
2NH3(g),在某压强恒定的密闭容器中加入2 mol N2和4 mol H2,达到平衡时,N2的转化率为50%,体积变为10 L。该条件下的平衡常数为___▲____;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com