
| A. | 0.16 moL•L-1 | B. | 0.08 moL•L-1 | C. | 0.04moL•L-1 | D. | 0.02moL•L-1 |
分析 由信息可知,
H2(g)+I2(g)?2HI(g)
开始 0.1 0.1 0
转化 0.08 0.08 0.16
平衡 0.02 0.02 0.16
则K=$\frac{0.1{6}^{2}}{0.02×0.02}$=64,
温度不变,则K不变,可知
H2(g)+I2(g)?2HI(g)
开始 0.2 0.2 0
转化 x x 2x
平衡 0.2-x 0.2-x 2x
$\frac{(2x)^{2}}{(0.2-x)(0.2-x)}$=64,以此来解答.
解答 解:由信息可知,
H2(g)+I2(g)?2HI(g)
开始 0.1 0.1 0
转化 0.08 0.08 0.16
平衡 0.02 0.02 0.16
则K=$\frac{0.1{6}^{2}}{0.02×0.02}$=64,
温度不变,则K不变,可知
H2(g)+I2(g)?2HI(g)
开始 0.2 0.2 0
转化 x x 2x
平衡 0.2-x 0.2-x 2x
$\frac{(2x)^{2}}{(0.2-x)(0.2-x)}$=64,
解得x=0.16mol/L,
则平衡时H2的浓度是0.2mol/L-0.16mol/L=0.04mol/L,
故选C.
点评 本题考查化学平衡的计算,为高频考点,把握平衡三段法及K的计算为解答的关键,侧重分析与计算能力的考查,注意温度不变时K不变,该题也可利用等效平衡来解答,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 原子间的强烈的静电作用 | B. | 阴、阳离子间的强烈的吸引作用 | ||
| C. | 阴、阳离子间的强烈的静电作用 | D. | 阴、阳离子间的强烈的排斥作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl、HBr、HI的分子间作用力依次增大,热稳定性也依次增强 | |
| B. | N2和Cl2两种分子中,每个原子的最外层都具有8电子稳定结构 | |
| C. | 在O2、CO2和SiO2中,都存在共价键,它们均由分子构成 | |
| D. | KOH和MgCl2都是离子晶体,均在共价键和离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 在接触室里用98.3%的浓硫酸吸收SO3,目的是防止形成酸雾便于SO3吸收完全 | |
| B. | 工业制玻璃和炼铁过程中都要加入石灰石,目的是除去杂质二氧化硅 | |
| C. | 工业上用金属钠与TiCl4溶液在高温下反应,目的是将金属钛从氯化物中置换出来 | |
| D. | 海水中提取镁的过程中加入贝壳煅烧制得的石灰,目的是将Mg2+转变成Mg(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
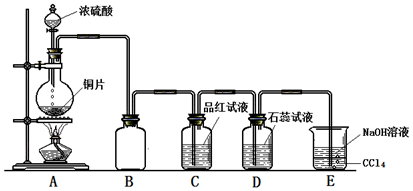
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化石能源物质内部蕴涵着大量的能量 | |
| B. | 绿色植物进行光合作用时,将太阳能转化为化学能“贮存”起来 | |
| C. | 吸热反应是反应物总能量大于生成物的总能量 | |
| D. | 物质的化学能可以在不同的条件下转化为热能、电能被人类利用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
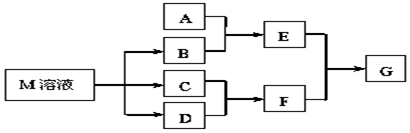

查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、K+、HCO3-、OH- | B. | Mg2+、Al3+、SO42-、NO3- | ||
| C. | K+、Cu2+、NH4+、NO3- | D. | H+、Na+、NO3-、CO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com