
| A�� | ԭ�������ͭ������0.15 mol | |
| B�� | ϡ��������ʵ���Ũ��Ϊ1 mol•L-1 | |
| C�� | ��һ��ʣ��9.6 g����Ϊͭ���� | |
| D�� | �ټ�������200 mLϡ���ᣬ����õ���״����2.24 L NO |
���� ��Ӧ�����Һ�м���KSCN��Һ����Һ����죬��ǡ����ȫ��Ӧ����û�����������ӣ�Ҳû������ʣ�ࣻ���Կ�����18g���������400mL���ᷴӦ����0.2mol NO����ͭȫ�����ɶ��۵����ӣ������ķ�Ӧ���ӷ���ʽΪ��3Fe+8H++2NO3-=3Fe2++2NO��+4H2O��3Cu+8H++2NO3-=3Cu2++2NO��+4H2O���ֱ��������ͭ�����ʵ��������ݹ�������������������������ʽ���㣬Ȼ��Ը�ѡ������жϣ�
��� �⣺��Ӧ�����Һ�м���KSCN��Һ����Һ����죬˵��ǡ����ȫ��Ӧ����û�����������ӣ�Ҳû������ʣ�࣮���Կ�����18g���������400ml���ᷴӦ����0.2mol NO����ͭȫ�����ɶ��۵����ӣ�����Ϊxmol��ͭΪymol�������ķ�Ӧ���ӷ���ʽΪ��3Fe+8H++2NO3-=3Fe2++2NO��+4H2O��3Cu+8H++2NO3-=3Cu2++2NO��+4H2O����
56x+64y=18��$\frac{2}{3}$x+$\frac{2}{3}$y=0.2��
��ã�x=0.15mol��y=0.15mol ����õ�18g������к�������Ϊ��0.15mol��56g/mol=8.4g������ͭ����Ϊ��0.15mol��64g/mol=9.6g��
A��ԭ�������ͭ������0.15mol����A��ȷ��
B�������������ʵ���Ϊ0.3mol�����ݷ�Ӧ��֪������������ʵ���Ϊ��0.3mol��$\frac{8}{3}$=0.8mol��������Ũ��Ϊ��c��HNO3��=$\frac{0.8mol}{0.4L}$=2mol/L����B����
C��������к���8.4g����9.6gͭ���������Դ���ͭ���������ȷ�Ӧ���ʵ�һ��ʣ�����9.6gΪͭ����C����
D����Һ�ж���������Ϊ0.15mol�����ݵ����غ��ټ������NOΪ��$\frac{0.15��1}{3}$=0.05mol����������Ϊ22.4L/mol��0.05mol=1.12L����D����
��ѡA��
���� ���⿼���˻���ﷴӦ�ļ��㣬��Ŀ�Ѷ��еȣ��漰��������ʡ�����ͭ�����������ʵ�Ӧ�ã����ݷ�Ӧ��������ļ����ж��ǽ���ؼ�������������ѧ���ķ�����������ѧ����������


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | CH3CH=CH2�� | B�� | ��Ȳ�ͱ� | C�� |  �� �� | D�� | ����������ѿ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������ʹ���Ը��������Һ��ɫ | B�� | �����ڶ���ȡ������ֻ��һ�� | ||
| C�� | ����ʹ������Ȼ�̼��Һ��ɫ | D�� | ���ĶԶ���ȡ������ֻ��һ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Al+HCl | B�� | Al+O2 | C�� | Al+MgO | D�� | Al+Fe2O3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��2-��-1-��ϩ��CH2=CH��CH3��CH2CH2CH3
��2-��-1-��ϩ��CH2=CH��CH3��CH2CH2CH3�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ѧ����һ�������� | |
| B�� | ��ѧ������ʹ�������ϣ�Ҳ����ʹԭ������ | |
| C�� | �Ǽ��Լ����ǻ�ѧ�� | |
| D�� | ��ѧ��Ӧ�����У���Ӧ������ڵĻ�ѧ�����ѣ���������еĻ�ѧ���γ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
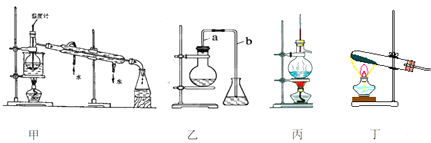
| A�� | װ�üף�ʯ�ͷ��� | B�� | װ���ң��屽����ȡ | ||
| C�� | װ�ñ�����ϩ����ȡ | D�� | װ�ö���������������ȡ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | C2H5OH��l��+3O2��g��=2CO2��g��+3H2O��g����H=-1367.0kJ/mol ����H�����Ҵ���ȼ���ȣ� | |
| B�� | HCl ��aq��+NaOH��aq��=NaCl��aq��+H2O��1����H=-57.3kJ/mol ����H�����к��ȣ� | |
| C�� | 2H2O��g��=2H2��g��+O2��g����H=+483.6 kJ/mol ����Ӧ�ȣ� | |
| D�� | C��s��+O2��g���TCO2��g����H=+393.5 kJ/mol ����Ӧ�ȣ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��pH=5�Ĵ�����Һϡ�ͺָ���ԭ�¶ȣ�pH��Kw������ | |
| B�� | 25��ʱ��pH=3���Ȼ����Һ�У�c��OH-��=1.0��10-11mol•L-1 | |
| C�� | 25��ʱ��pH=4���Ȼ����Һ�У�c��Cl-����c��NH4+����c��H+����c��OH-�� | |
| D�� | ��NH4HSO4��Һ�м�������ʵ�����NaOH�γɵ���Һ�У�c��Na+��=c��SO42-����c��NH4+����c��H+����c��OH-�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com