
【题目】在含有ag HNO3的稀硝酸中,加入bg铁粉充分反应,铁全部溶解并生成NO,有![]() g HNO3被还原,则a∶b不可能为( )
g HNO3被还原,则a∶b不可能为( )
A. 2∶1 B. 3∶1 C. 4∶1 D. 9∶2
科目:高中化学 来源: 题型:
【题目】下列各组离子能大量共存的是( )
A.Ba2+、Fe3+、OH﹣、Cl﹣B.Mg2+、Na+、Cl﹣、SO42﹣
C.NH4+、Ba2+、NO3﹣、OH﹣D.H+、K+、NO3﹣、CO32﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质反应时,反应物用量或反应条件的改变对生成物无影响的是( )
A.C和O2B.Na2CO3和盐酸C.Na和O2D.NaHCO3和NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配合物Fe(CO)5的熔点一20℃,沸点103℃。可用于制备纯铁。Fe(CO)5的结构如图所示。

(1)基态Fe原子的价电子排布式是_____________________;Fe(CO)5晶体类型属于__________晶体。
(2)CO分子中C、O原子都满足8电子稳定结构,CO分子的结构式是________,写出与CO互为等电子体的分子的电子式:___________________。
(3)C、O、Fe的第一电离能由大到小的顺序为_______________________。
(4)关于Fe(CO)5,下列说法正确的是______。
A. Fe(CO)5是非极性分子,CO是极性分子 B. Fe(CO)5中Fe原子以sp3杂化方式与CO成键
C.1molFe(CO)5含有10mol配位键 D.Fe(CO)5==Fe+5CO反应中没有新化学键生成
(5)铁的三种晶体的晶胞均为立方晶胞,三种晶体的晶胞如下图所示。

①上述三种晶体的晶胞中属于面心晶胞的是______(填“a”“δ””或“γ”)-Fe。
②a-Fe晶胞中铁原子的配位数为_______________。
③γ-Fe晶胞的边长为apm,则γ-Fe单质的密度为____g/cm3(NA表示阿伏伽德罗常数的值,列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人工光合作用能够借助太阳能,用CO2和H2O制备化学原料。如图是通过人工光合作用制备HCOOH的原理示意图,下列说法不正确的是
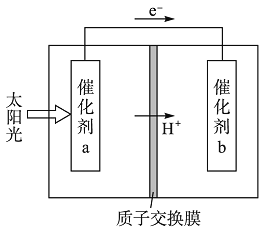
A. 该过程是将太阳能转化为化学能的过程
B. 催化剂a表面发生氧化反应,有O2产生
C. 催化剂a附近酸性减弱,催化剂b附近酸性增强
D. 催化剂b表面的反应是CO2+2H++2e-=HCOOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。

(1)硫酸具有A-D所示的性质,以下过程主要表现了浓硫酸的那些性质?请将选项字母填在下列各小题的横线上:
A强酸性 B 吸水性 C 脱水性 D 强氧化性
①浓硫酸可以干燥氢气__________
②浓硫酸使木条变黑__________
③热的浓硫酸与铜片反应__________
(2)现用该浓硫酸配制100mL 1mol/L的稀硫酸。可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平。请回答下列问题:
(i)配制稀硫酸时,上述仪器中不需要使用的有__________(选填序号),还缺少的仪器有__________(写仪器名称);
(ii)经计算,配制100mL1mol/L的稀硫酸需要用量筒量取上述浓硫酸的体积为__________mL(保留一位小数),
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇可作为燃料电池的原料。通过下列反应可以制备甲醇:CO ( g ) + 2H2( g )CH3OH ( g ) △H=-90.8 kJ·mol-1在一容积可变的密闭容器中充入10 mol CO 和20 molH2,CO 的平衡转化率随温度(T)、压强(P)的变化如图所示,当达到平衡状态A时,容器的体积为20 L。
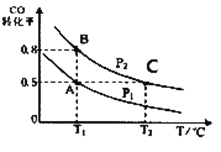
(1)该反应的化学平衡常数表达式为_____________。
(2)图中正反应速率:ν(A)___ν(B);平衡常数: K(A)_____K(C);平均摩尔质量:M(B)_____M(C)(填“>”、“<”或“=”)。
(3)关于反应CO(g)+2H2(g) CH3OH(g)在化学平衡状态时的描述正确的是_______(填字母)。
A.CO的含量保持不变
B.2V正(CH3OH)=V正(H2)
C.容器中CH3OH浓度与CO浓度相等
D.容器中混合气体的密度保持不变
(4)如反应开始时仍充入10mol CO 和20mol H2,则在平衡状态B时容器的体积V(B)为__________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美、德两国成功合成具有化学特性的氢铝化合物(AlH3)n,关于氢铝化合物的推测不正确的是 ( )。
A.氢铝化合物与水反应生成氢氧化铝和氢气
B.氢铝化合物中铝显+3价,氢显-1价
C.铝与水蒸气在高温下反应可生成氢铝化合物
D.氢铝化合物具有强还原性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com