
| A、直线形式上 |
| B、平面正方形 |
| C、正四面体形 |
| D、正八面体形 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、AlCl3溶液蒸干、灼烧至恒重,最终剩余固体是AlCl3 |
| B、向煮沸的1 mol?L-1NaOH溶液中滴加FeCl3饱和溶液可制备Fe(OH)3胶体 |
| C、等体积pH=12的氨水和pH=12的NaOH溶液可中和含等物质的量HCl的盐酸 |
| D、锅炉中沉积的CaSO4可用饱和Na2CO3溶液浸泡,再将不溶物用酸去除 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 组合 分类 | 碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 |
| A | 纯碱 | 盐酸 | 烧碱 | 氧化铝 | 二氧化硫 |
| B | 烧碱 | 硫酸 | 食盐 | 氧化铁 | 二氧化氮 |
| C | 苛性钠 | 石炭酸 | 硫酸铵 | 过氧化钠 | 二氧化硅 |
| D | 苛性钾 | 硬脂酸 | 小苏打 | 氧化钙 | 五氧化二磷 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、石灰石与盐酸反应:CO32-+2H+=CO2↑+H2O |
| B、氢氧化钡与稀硫酸反应:Ba2++SO42-=BaSO4↓ |
| C、铁与稀硫酸反应:2Fe+6H+=2Fe3++3H2↑ |
| D、碳酸钠与石灰水反应:Ca2++CO32-?=CaCO3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:1 | B、2:1 |
| C、2:3 | D、3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
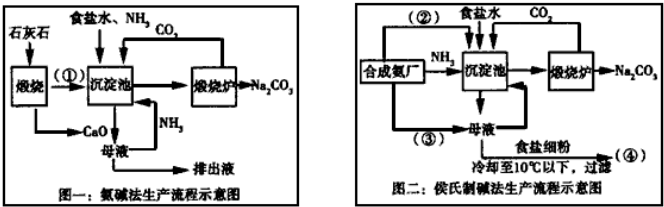
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(H+) |
| c(CH3COOH) |
| A、加少量烧碱溶液 |
| B、加入金属锌 |
| C、加少量冰醋酸 |
| D、加水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、448mL |
| B、672mL |
| C、896mL |
| D、224mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
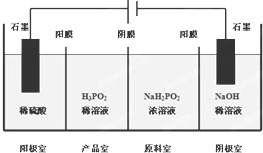 次磷酸(H3PO2)是一种精细磷化工产品,具有较强的还原性.回答下列问题:
次磷酸(H3PO2)是一种精细磷化工产品,具有较强的还原性.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com