
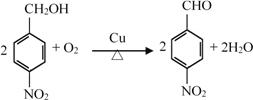
【题目】有机物X是合成抗痛风药非布司他的一种中间体,其合成路线如下图所示:
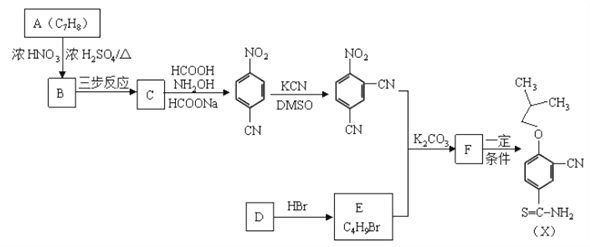
已知: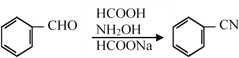
(1)A是一种重要的化工原料和有机溶剂,其结构简式是________。
(2)A![]() B的反应类型是________。
B的反应类型是________。
(3)C中所含的官能团是________。
(4)B![]() C可通过三步反应完成,请选择必要的无机试剂完成该转化,写出有关反应的化学方程式________、________、________。
C可通过三步反应完成,请选择必要的无机试剂完成该转化,写出有关反应的化学方程式________、________、________。
(5)D是一种烃,D![]() E时可能产生的副产物结构简式是________。
E时可能产生的副产物结构简式是________。
(6)F与![]() 在一定条件下反应生成X,写出F的结构简式________。
在一定条件下反应生成X,写出F的结构简式________。
【答案】 ![]() 取代反应 —NO2(硝基)—CHO(醛基)
取代反应 —NO2(硝基)—CHO(醛基) 
![]()
【解析】A是一种重要的化工原料和有机溶剂,其结构简式是![]() ,与浓硫酸和浓硝酸发生取代反应生成B,B为
,与浓硫酸和浓硝酸发生取代反应生成B,B为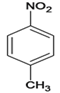 ,B经过取代、水解、氧化三步得到C、
,B经过取代、水解、氧化三步得到C、![]() ,反应后得
,反应后得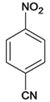 、
、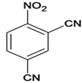 ,D为:
,D为: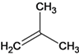 ,与HBr加成后得E,
,与HBr加成后得E, 副产品为
副产品为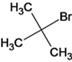 ,E与
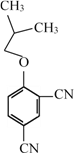
,E与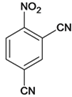 得F,F为
得F,F为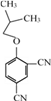 。
。
(1)A是一种重要的化工原料和有机溶剂,其结构简式是![]() 。(2)A与浓硫酸和浓硝酸发生取代反应生成B,A
。(2)A与浓硫酸和浓硝酸发生取代反应生成B,A![]() B的反应类型是取代反应。(3)C
B的反应类型是取代反应。(3)C![]() 中所含的官能团是 —NO2(硝基)—CHO(醛基)。(4)B
中所含的官能团是 —NO2(硝基)—CHO(醛基)。(4)B![]() C可通过三步反应完成,经过取代、水解、氧化三步得到C、
C可通过三步反应完成,经过取代、水解、氧化三步得到C、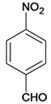 ,有关反应的化学方程式:取代反应
,有关反应的化学方程式:取代反应 ,水解生成醇:
,水解生成醇: 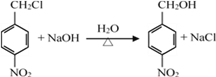 ,醇氧化成醛
,醇氧化成醛 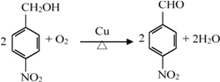 。(
。( ,D
,D![]() E时可能产生的副产物结构简式是
E时可能产生的副产物结构简式是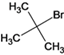 。(6)F与
。(6)F与![]() 在一定条件下反应生成X,写出F的结构简式
在一定条件下反应生成X,写出F的结构简式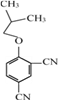 。
。


科目:高中化学 来源: 题型:
【题目】下列有关石墨晶体的说法正确的是( )
A. 由于石墨晶体导电,所以它是金属晶体
B. 由于石墨的熔点很高,所以它是原子晶体
C. 由于石墨质软,所以它是分子晶体
D. 石墨晶体是一种混合晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在固定容积的密闭容器中,可逆反应A(g)+3B(g) ![]() 2C(g)达到平衡时,各物质的物质的量之比为n(A)∶n(B)∶n(C)=2∶2∶1。保持温度不变,以2∶2∶1的物质的量之比再充入A、B、C,则 ( )
2C(g)达到平衡时,各物质的物质的量之比为n(A)∶n(B)∶n(C)=2∶2∶1。保持温度不变,以2∶2∶1的物质的量之比再充入A、B、C,则 ( )
A. 平衡不移动
B. 再达平衡时,n(A)∶n(B)∶n(C)仍为2∶2∶1
C. 再达平衡时,C的体积分数增大
D. 再达平衡时,正反应速率增大,逆反应速率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应:mA(g)+nB(?)![]() xC(g) △H,在不同温度及压强(p1,p2)条件下,反应物A的转化率如图所示,下列判断正确的是
xC(g) △H,在不同温度及压强(p1,p2)条件下,反应物A的转化率如图所示,下列判断正确的是
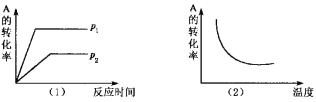
A. △H >0,m+n>x,同时B为非气态
B. △H >0,m+n<x,同时B为气态
C. △H <0,m+n>x,同时B为气态
D. △H <0,m<x,同时B为非气态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在温度为T时,向2.0 L恒容密闭容器中充入1.0 molA和1.0 molB,发生反应A(g)+B(g)![]() C(g),一段时间后达到平衡。测定得部分数据见下表:
C(g),一段时间后达到平衡。测定得部分数据见下表:
t/s | 0 | 5 | 15 | 25 | 35 |
n(A)/mol | 1.0 | 0.85 | 0.81 | 0.80 | 0.80 |
回答下列问题:
(1)反应前5 s的平均反应速率v(A)=____________。
(2)温度为T时,达到平衡后B物质的量的浓度=________。
(3)升高温度,平衡时c(A)=0.41 mol·L-1,则反应的ΔH_______(填“>0”或“<0”)。
(4)下列措施能增大反应速率,且平衡向正反应方向移动是__________。
a.及时分离出A气体 b.适当升高温度
c.增大B的浓度 d.选择高效催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物存在如下转化关系:
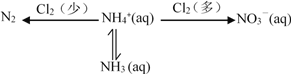
(1)在氨氮废水中通入一定量的氯气,利用产生的HClO可除去废水中含有的游离氨或铵盐。
已知 NH4+ + HClO ![]() NH2Cl + H+ + H2O H = a kJmol-1
NH2Cl + H+ + H2O H = a kJmol-1
2NH2Cl + HClO ![]() N2 + H2O + 3H+ + 3Cl- H = b kJmol-1
N2 + H2O + 3H+ + 3Cl- H = b kJmol-1
则 2NH4+ + 3HClO ![]() N2 + 3H2O + 5H+ + 3Cl- H =______kJmol-1
N2 + 3H2O + 5H+ + 3Cl- H =______kJmol-1
(2)电解法也可除去水中的氨氮,实验室用石墨电极电解一定浓度的(NH4)2SO4与NaCl的酸性混合溶液来模拟。
① 电解时,阳极的电极反应式为________。
② 电解过程中,溶液初始Cl-浓度和pH对氨氮去除速率与能耗(处理一定量氨氮消耗的电能)的影响关系如图1和图2所示。

图1 Cl-浓度对氨氮去除速率、能耗的影响 图2初始pH对氨氮去除速率、能耗的影响
图1中当Cl-浓度较低时、图2中当初始pH达到12时,均出现氨氮去除速率低而能耗高的现象,共同原因是________;图2中,pH为6时处理效果最佳,当pH过低时,处理效果不佳的原因可能是________。
③ 当溶液中Cl-浓度较高时,测得溶液中的NO![]() 浓度会随之增大,可能的原因是________。
浓度会随之增大,可能的原因是________。
(3)某工厂将含NH4+废水的去除与工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分)的去除结合起来,设计了如下方案:
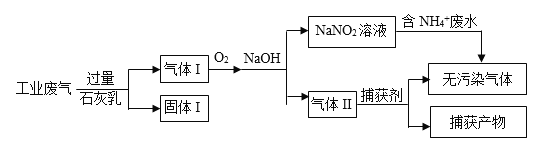
① 固体I的成分为________。
② 为使100L 150 mg/L(浓度均以氮原子计,下同)的含NH4+ 废水达到国家二级排放标准10mg/L,图中通入的氧气在标准状况下的体积至少为________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置进行实验,下列有关说法正确的是( )
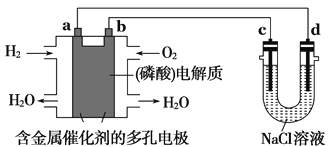
A. 电子流向为:电极a → 电极d →电极c →电极b
B. 电极b发生的电极反应为O2 + 2H2O + 4e- = 4OH-
C. 在电极a参与反应的气体体积在相同状况下与在电极c产生的气体体积为1:1
D. 为了防止大气污染,应在d端的U形管出口连接导管通入到NaOH溶液中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、氨气是重要化工原料,在国民经济中占重要地位。工业合成氨的反应为:N2(g)+3H2(g)![]() 2NH3(g) △H<0。右图表示合成NH3反应在某段时间t0→t6中反应速率与反应过程的曲线图,t1、t3、t4时刻分别改变某一外界条件,则在下列到达化学平衡的时间段中,NH3的体积分数最小的一段时间是(填写下列序号,下同)_______,化学平衡常数最大的一段时间是________。
2NH3(g) △H<0。右图表示合成NH3反应在某段时间t0→t6中反应速率与反应过程的曲线图,t1、t3、t4时刻分别改变某一外界条件,则在下列到达化学平衡的时间段中,NH3的体积分数最小的一段时间是(填写下列序号,下同)_______,化学平衡常数最大的一段时间是________。
a. t0→t1 b.t2→t3 c.t3→t4 d.t5→t6
t4时改变的条件是_______________。

Ⅱ、已知反应:Fe(s)+CO2(g) ![]() FeO(s)+CO(g) H=akJ·mol-1测得在不同温度下,该反应的平衡常数K值随温度的变化如下表所示:
FeO(s)+CO(g) H=akJ·mol-1测得在不同温度下,该反应的平衡常数K值随温度的变化如下表所示:
温度/℃ | 500 | 700 | 900 |
K | 1.00 | 1.47 | 2.40 |
(1)若在500℃2L密闭容器中进行该反应,CO2起始量为4mol,5min后达到平衡状态,则这段时间内,用CO表达的反应速率为__________.(填写计算所得数值及单位)
(2)下列图像符合该反应的是_____________(填序号)(图中v代表速率、ω代表混合物中CO的含量,T代表温度)。


(3)下列能说明此反应在500℃达到平衡状态的是___________
①CO的体积分数不变
②固体质量不变
③恒压条件下,气体的体积不变
④恒容条件下,容器内压强不再改变
⑤c(CO)=c(CO2)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com