
| 酸或碱 | 电离常数(Ka或Kb) |
| CH3COOH | 1.8×10-5 |
| HF | 3.53×10-4 |
| HCN | 5×10-10 |
| H2SO3 | Ka1=1.54×10-2;Ka2=1.02×10-7 |
| NH3?H2O | 1.8×10-5 |
| 难(微)溶物 | 溶度积常数(Ksp) |
| BaSO4 | 1×10-10 |
| BaCO3 | 2.6×10-9 |
| Mg(OH)2 | 5.61×10-12 |
| MgCO3 | 6.82×10-6 |
| A、酸性:HF>CH3COOH>H2SO3>HCN |
| B、根据溶度积常数(Ksp),甲同学认为除NaCl溶液中少量的MgCl2杂质需要加稍过量的NaOH溶液,而不是Na2CO3溶液;乙同学认为即使在BaSO4悬浊液中加过量的纯碱溶液,BaSO4也不会转化为BaCO3 |
| C、浓度相同的NaCN溶液和HCN的溶液等体积混合,其pH>7,溶液中各离子浓度大小为:c(OH-)>c(H+)>c(Na+)>c(CN-) |
| D、CH3COONH4水溶液显中性,是因为根据电离常数,CH3COO-结合H+与NH4+结合OH-生成弱电解质的程度一样,导致水溶液中的H+与OH-浓度相等 |


科目:高中化学 来源: 题型:
| A、①③ | B、②④ | C、①④ | D、②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①、②、⑥、⑦分子中碳原子数小于10 |
| B、①、②是无机物,③、⑤、⑦是有机物 |
| C、①是酸性化合物,②不是酸性化合物 |
| D、②、③、④含氧元素,⑤、⑥、⑦不含氧元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、SO2和NO2溶于水都显酸性,因而它们都是酸性氧化物 |
| B、Na2O和NH3的水溶液均能导电,故均为电解质 |
| C、Si和SiO2均属于原子晶体 |
| D、Na2O和Na2O2与水反应均会生成强碱,故都是碱性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
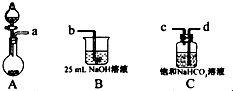 研究碳及其化合物的性质和用途是中学化学的任务之一.
研究碳及其化合物的性质和用途是中学化学的任务之一.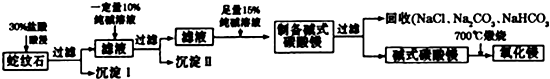
查看答案和解析>>
科目:高中化学 来源: 题型:
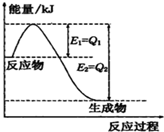 ①一定条件下,N2和H2反应生成lmolNH3过程中能量变化如图所示,则1mol N2完全反应时的焓变为:
①一定条件下,N2和H2反应生成lmolNH3过程中能量变化如图所示,则1mol N2完全反应时的焓变为:查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | A | B | C | D | E |
| 化合价 | -4 | -3 | -2 | +1 | -1 |
| 1 |
| 3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com